Перейти к:
Тромбоэмболия легочной артерии у двух девочек-подростков. Клинические случаи
https://doi.org/10.31146/2949-4664-apps-3-1-68-75
Аннотация
Актуальность. Тромбоэмболия легочной артерии (ТЭЛА) характеризуется острой перестройкой параметров центральной гемодинамики в большом и малом кругах кровообращения и является одним из частых жизнеугрожающих состояний среди взрослых пациентов. Несмотря на то что первое описание ТЭЛА было представлено фон Лешнером в 1861 году, до настоящего времени в педиатрической практике нет должной настороженности к подобному осложнению. Это объясняется не только отсутствием системных знаний о распространенности ТЭЛА в детской популяции, но и из-за стертости, а порой и нетипичной, в отличие от взрослого пациента, клинической картины. Неверная интерпретация имеющихся симптомов, ошибочная трактовка данных инструментальных методов исследования неизбежно приводят к неверному диагнозу: пневмония, сердечная недостаточность, дебют онкологического заболевания, что объясняет высокую летальность при ТЭЛА у детей.
Цель. Демонстрация случаев ТЭЛА при наличии значимых факторов риска — прием пероральных контрацептивов, снижение уровня протеинов C и S у двух девочек-подростков.
Материалы и методы. Представлены 2 случая клинически и/или инструментально подтвержденных эпизодов ТЭЛА у девушек 17 и 14 лет. ИМТ в одном и другом случае составил 25,9 и 25,15 кг/м2 соответственно. Среди инструментальных методов исследования были выполнены ЭКГ, трансторакальная ЭхоКГ, мультиспиральная компьютерная томография (МСКТ) с контрастированием. Лабораторная диагностика антифосфолипидного синдрома, анализ на тромбофилию были обязательным дополнением клиническому, биохимическому анализам крови и коагулограмме с определением уровня АТ-III и D-димера.
Результаты. Среди клинических симптомов, имеющих диагностическую ценность в дебюте заболевания, были одышка, боли в области грудной клетки, кашель, кровохарканье. Ни в одном, ни в другом случае эпизод ТЭЛА не привел к повышению давления в легочной артерии, о чем свидетельствовали показатели давления в правом желудочке (ПЖ): 24 и 20 мм рт. ст. соответственно. МСКТ с контрастированием подтвердила диагноз субмассивной ТЭЛА и признаки инфаркт-пневмонии в одном и другом случаях. УЗДГ не обнаружила источника ТЭЛА в сосудах нижних конечностей и малого таза ни у одной из девушек. Прием пероральных контрацептивов в одном случае и снижение уровня протеинов С и S в другом явились значимыми факторами развития ТЭЛА. Лечебная тактика заключалась в назначении низкомолекулярных гепаринов (НМГ) с переходом на непрямые антикоагулянты: апиксабан и варфарин соответственно. Выполненная через месяц МСКТ свидетельствовала о положительной динамике заболевания, но не полном восстановлении воздушности легочной ткани. Терапия непрямыми антикоагулянтами была продолжена.
Заключение. Частота встречаемости ТЭЛА в детской популяции реже, чем у взрослых, но это не снижает уровня значимости данного грозного осложнения в педиатрической практике. Центральные венозные катетеры, септические осложнения, длительная иммобилизация, шунтированная гидроцефалия, онкология, ожирение являются наиболее вероятными причинами ТЭЛА у детей, как и у взрослых пациентов. Прием оральных контрацептивов и наследственные тромбофилии в двух наших наблюдениях свидетельствуют о других не менее очевидных причинах возникновения ТЭЛА у детей подросткового возраста.
Ключевые слова
Для цитирования:
Дроздова А.И., Хиштилова П.Б. Тромбоэмболия легочной артерии у двух девочек-подростков. Клинические случаи. Архив педиатрии и детской хирургии. 2025;3(1):69-76. https://doi.org/10.31146/2949-4664-apps-3-1-68-75
For citation:
Drozdova A.I., Hishtilova P.B. Pulmonary thromboembolism in two adolescent girls. Clinical cases. Archives of Pediatrics and Pediatric Surgery. 2025;3(1):69-76. (In Russ.) https://doi.org/10.31146/2949-4664-apps-3-1-68-75
Введение
ТЭЛА — окклюзия ствола или ветвей легочной артерии частичками тромба, сформировавшимися в венах большого круга кровообращения или правых камерах сердца, занесенными в легочное русло током крови. Существует три первичных фактора, влияющих на формирование тромба, названных по имени немецкого патолога триадой Вирхова. В своем фундаментальном труде «Gesammelte Abhandlungen zur Wissenschaftlichen Medicin» [1] в 1856 году он впервые описал и объяснил эту цепочку из трех событий и условий, которые должны произойти для возникновения тромбоза (рис. 1). Первое из них — это повреждение эндотелия; второе — стаз или завихрения (турбулентность) кровотока; третье — повышение свертываемости крови.
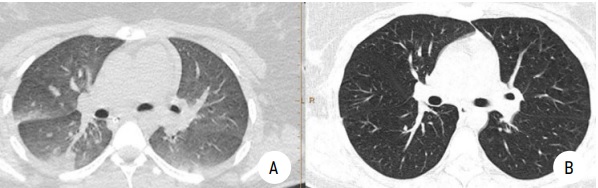
Рисунок 1.
МСКТ легких. Пациентка 2:
А — правосторонняя инфарктная пневмония на уровне нижней доли правого легкого. S5, S8, S9 до лечения;
B — контрольная МСКТ через 30 дней после начала лечения. Отсутствие инфильтративных и очаговых изменений
Figure 1.
MSCT of the lungs. Patient 2:
A — right-sided infarct pneumonia at the level of the lower lobe of the right lung. S5, S8, S9 before treatment;
B — control MSCT 30 days after the start of treatment. No infiltrative or focal changes.
Наиболее вероятными причинами повреждения эндотелия являются стояние центрального венозного катетера, системное воспаление как инфекционного (синдром системного воспалительного ответа), так и аутоиммунного происхождения (антифосфолипидный синдром, системные васкулиты).
Нарушение ламинарности кровотока чаще всего наблюдаются при врожденных или приобретенных пороках сердца, либо является следствием кардиохирургических вмешательств, нередко после операции Фонтена. Причиной возникновения стаза и повышения вязкости крови также может быть длительное парентеральное питание.
Среди приобретенных причин, приводящих к повышению свертываемости крови (тромбофилия), чаще всего выявляются онкологические заболевания, болезни почек на стадии нефротического синдрома. Беременность, длительная медикаментозная терапия L-аспарагиназой или прием гормональных эстроген-гестагенных препаратов могут приводить к нарушению гемостаза и тромбообразованию. Среди врожденных тромбофилий дефицит антикоагулянтов (протеинов S, C, антитромбина III, фактора Лейдена V), а также повышенный уровень гомоцистеина являются наиболее часто встречаемыми [2].
Несмотря на то что первое описание тромбоэмболии легочной артерии было предоставлено фон Лешнером еще в 1861 году [3], до настоящего времени в педиатрии нет ясного понимания данной проблемы из-за стертости или даже отсутствия клинической симптоматики и, как следствие, отсутствия настороженности у педиатров и детских кардиологов к данной патологии или неверной интерпретации имеющихся симптомов и ошибочной диагностики таких заболеваний, как пневмония, сердечная недостаточность или онкологическая патология.
Материалы и методы
За период с февраля 2023 по июль 2023 года в отделение детской кардиологии ГБУЗ МО «НИКИ детства» были госпитализированы две девушки 17 и 14 лет соответственно. В таблице 1 представлены основные клинико-инструментальные данные пациентов.
Клинический случай 1
Девушка 17 лет поступила в отделение 06.02.2023 г. Из анамнеза известно, что пациентка занималась биатлоном и соматически была здорова. До начала заболевания в течение 3 месяцев получала препараты линдинет и дюфастон по поводу дисфункции яичников. Больна с декабря 2022 года, когда появилась субфебрильная температура тела, слабость, небольшая одышка во время тренировок. Периодически самостоятельно принимала противовирусные лекарственные средства, однако сохранялась субфебрильная температура. В январе 2023 г. возникли 2 эпизода выраженных приступообразных болей в грудной клетке, усиливающихся при дыхании. Была обследована амбулаторно. На рентгенограмме грудного и поясничного отдела позвоночника были выявлены начальные признаки остеохондроза; сколиоз 1-й степени. Назначенная терапия (камбилипен внутримышечно, вольтарен местно, мидокалм перорально) значимого клинического эффекта не принесла. Через неделю девушка не смогла подняться по лестнице из-за боли в грудной клетке и одышки. В течение 3 дней — с 17 по 19 января — вновь повышение температуры тела (38,0–38,5), лечилась симптоматически амбулаторно. К исходу третьих суток возник очередной приступ выраженных болей в грудной клетке; появились боли в правом боку. В связи с тяжестью состояния 24.01.2023 г. была госпитализирована в стационар, где по данным рентгенографии была диагностирована двусторонняя полисегментарная пневмония. Была начата антибактериальная терапия, которая не принесла должного клинического эффекта спустя неделю (сохранялось повышение температуры тела, одышка, боли в грудной клетке), что потребовало выполнения МСКТ органов грудной клетки с контрастированием, где и была диагностирована тромбоэмболия сегментарных и субсегментарных ветвей легочной артерии. Для продолжения терапии была переведена в детское кардиологическое отделение. При обследовании: по данным ЭКГ обнаружены синусовый ритм, вертикальное положение ЭОС, неполная блокада правой ножки пучка Гиса (НБПНПГ), смещение переходной зоны в V5. ЭхоКГ зарегистрировала нормальное давление в легочной артерии, отсутствие увеличения правых отделов сердца, ТАРSЕ 3,2 см (табл. 1). Левый желудочек не расширен: КДР ЛЖ 5,3 см, КСР ЛЖ 3,5 см, КДО 137 мл, КСО 51 мл, ФВ 62%, ФУ 33%, ИКДО 68 мл/м2. Митральная регургитация 0–1 ст., трикуспидальная регургитация 0–1 ст., расчетное систолическое давление в правом желудочке 24 мм рт. ст.
Титры антител к двуспиральной ДНК (a-dsDNA), G и M к b2 гликопротеину, G к кардиолипину и показатель волчаночного антикоагулянта свидетельствовали об отсутствии у пациентки как первичного, так и вторичного антифосфолипидного синдрома. Острофазовые показатели системного воспаления — прокальцитонин, СРБ — были в пределах клинической нормы, а уровни миоглобина, КФК-МВ и тропонина 18,4 (норма 14,3–65,8) не отражали повреждение миокарда. Кроме этого, NT-proBNP < 100 пг/мл свидетельствовал об отсутствии скрытых, лабораторных признаков сердечной недостаточности. В показателях коагулограммы зафиксировано более чем пятикратное повышение D-димера (2337 нг/мл) (табл. 2).
Была начата терапия НМГ: эноксипарин с последующим переводом на пероральный прием препарата апиксабан в дозе 10 мг/сут. МСКТ легких с контрастированием, выполненная через 1 месяц после начала терапии продемонстрировала положительный, но не окончательный регресс заболевания. Терапия была продолжена амбулаторно.
Клинический случай 2
Девушка 14 лет поступила в ГБУЗ МО «НИКИ детства» 03.08.2023 г. Из анамнеза известно, что больна с июня 2023 г., когда появился кашель и повышение температуры тела до субфебрильных цифр. Обратилась в поликлинику по месту жительства, была назначена симптоматическая терапия. Кашель ¬сохранялся и приобрел приступообразный характер; появилась одышка по ночам. Через 2 недели после начала заболевания, вечером 07.07.2023 г., во время просмотра фильма закашлялась и потеряла сознание; позже появилось кровохарканье. Была вызвана бригада скорой помощи, и пациентка госпитализирована в отделение реанимации. В связи с выраженностью дыхательной недостаточности была переведена на ИВЛ. По данным МСКТ с контрастированием диагностирована ТЭЛА; полисегментарная инфаркт-пневмония. По мере стабилизации состояния была экстубирована и переведена в детское кардиологическое отделение.
При обследовании на момент перевода в отделение показатели витальных функций — ЧСС, АД, SaO2 — были в пределах нормы. Данные инструментальных методов исследования — ЭКГ, ЭхоКГ — свидетельствовали об отсутствии перегрузки правых отделов сердца, повышения давления в системе легочных артерий (правый желудочек 2,0 см, ТАРSЕ 2,8 см. Левый желудочек не расширен КДР ЛЖ 4,8 см, КСР ЛЖ 3,0 см, КДО 108 мл, КСО 37 мл, ФВ 65%, ФУ 35%, иКДО 66 мл/м2). Митральная регургитация 0–1 ст. Трикуспидальная регургитация 0–1 ст., расчетное систолическое давление в правом желудочке 20 мм рт. ст. (табл. 1).
Таблица 1.
Клинико-инструментальная характеристика больных
Table 1.
Clinical and instrumental characteristics of the patients
Пациент 1 | Пациент 2 | |
Возраст (лет) | 17 | 14 |
Рост (см) | 179 | 158 |
Вес (кг) | 83 | 63 |
BSA м2 | 2,0 | 1,65 |
ИМТ | ||
Жалобы | Одышка, «опоясывающие» боли в грудной клетке и правом боку | Кашель, кровохарканье, cинкопе |
Факторы риска | Прием пероральных контрацептивов | Снижение уровня протеинов C, S |
Длительность заболевания | 2 мес | 1,5 мес |
Необходимость ИВЛ | Нет | Да |
ЧСС (в мин) | 74 | 92 |
АД (мм рт. ст.) | 108/57 | 113/67 |
SaО2 (%) | 99 | 99 |
ЭКГ: Эл. ось сердца PQ (с) QTс (с) Внутрижелудочковые блокады | вертикальная 0,14 0,40 НБПНПГ | Нормальная 0,13 0,42 нет |
ЭхоКГ: КДР притока ПЖ (см) P ПЖ (мм рт. ст.) | 2,3 24 | 2,0 20 |
УЗДГ вен нижних конечностей и малого таза | Тромбоза нет | Тромбоза нет |
МСКТ — дебют заболевания | Двусторонняя инфаркт-пневмония в S8, S9 правого легкого и S10 левого легкого. Признаки субмассивной ТЭЛА. | Правосторонняя инфаркт-пневмония S5, S8, S9 Признаки субмассивной ТЭЛА |
МСКТ — через 30 дней от начала заболевания | Двусторонняя инфаркт-пневмония в S8, S9 правого легкого и S10 левого легкого, в фазе разрешения. | На основании КТ картины данных за ТЭЛА, очаговых, инфильтративных изменений в легких не выявлено |
Терапия | НМГ (эноксипарин) 14 дней с переходом на апиксабан 10 мг/сут | Гепарин — |
Лабораторные показатели свидетельствовали о снижении уровня протеина С и S до 47 и 44% соответственно (табл. 2). При УЗДГ вен нижних конечностей и малого таза источников тромбоэмболии в легкие не обнаружено.
Таблица 2.
Лабораторные показатели
Table 2.
Laboratory indicators
Пациент 1 | Пациент ٢ | |
a-dsDNA, IgG | 2,2 | 6,6 |
АТ b2-GP1-G | 1,3 | Не обнаружены |
АТ b2-GP1-M | Не обнаружены | Не обнаружены |
АТ CLP-IgM | Не обнаружены | Не обнаружены |
Волчаночный антикоагулянт | 1,0 | Не обнаружен |
СРБ | 7,7 | 5,5 |
Прокальцитонин | < 0,02 | 0,01 |
КФК-МВ | 0,9 | 0,7 |
Миоглобин | 18,4 | 16,4 |
Тропонин | < 3,2 | 1,3 |
NT pro-BNP | 26,3 | 26,8 |
D-димер (нг/мл) | 2337 | 259 |
ПТИ (%) | 82 | 46,6 |
АТ III | 89 | 117 |
Фибриноген | 3,6 | 5,3 |
Протеин С % | 90 | 47 |
Протеин S % | 87 | 44 |
В отделении была продолжена терапия варфарином, для достижения целевого значения МНО (2–2,5). При МСКТ органов грудной клетки с контрастированием через 1 месяц от начала терапии отмечена положительная динамика в виде полного регресса тромбоэмболии и очагов инфаркт-пневмонии (рис. 1, 2). В настоящее время пациентка проходит обследование у гематолога.
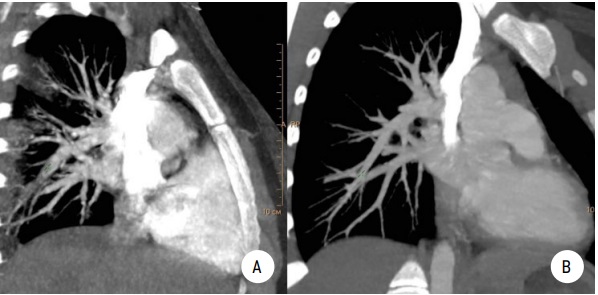
Рисунок 2.
МСКТ легких с контрастированием. Пациентка 2:
А — субмассивная ТЭЛА, правосторонняя полисегментарная инфарктная пневмония;
B — контрольная МСКТ с контрастированием через 30 дней после начала лечения. Выраженная положительная динамика
Figure 2.
MSCT of the lungs. Patient 2:
A — submassive pulmonary embolism, right-sided polysegmental infarct pneumonia;
B — control MSCT 30 days after the start of treatment. Significant improvement.
Обсуждение
Сравнительно небольшое число клинических исследований ТЭЛА у детей объясняет разнящиеся данные о ее распространенности. В представленных в публикациях частота ТЭЛА у находящихся в стационаре детей колеблется от 8,6 до 57 случаев на 100 000. При изучении общей популяции среди не госпитализированных пациентов частота ТЭЛА значимо меньше, составляя от 0,14 до 0,9 случаев на 100 000 [4][5–8]. Ретроспективное исследование, проведенное в одном из Центров Бразилии, показало частоту встречаемости ТЭЛА 3,3 на 10 000 госпитализированных детей (23 наблюдения за 10 лет) [9]. Во всех этих случаях дети имели факторы риска, причем в 69,5% — два и более. Прогностически наиболее значимые из них — это установленный центральный венозный катетер (39,1%), злокачественные заболевания (34,8%), перенесенное хирургическое вмешательство (34,8%). Надо отметить, что известные в клинической практике предикторы возникновения ТЭЛА, такие как критерии Велла, Женевская шкала, критерии, исключающие легочную эмболию (PERC-pulmonary embolism rule-out criteria), объединяют клинические симптомы и дополнительные факторы риска для диагностики ТЭЛА у взрослых пациентов. В педиатрической практике подобная модель еще не апробирована [10][11][12].
Существует мнение, что в детском возрасте наблюдается два пика заболеваемости ТЭЛА — младенческий и подростковый [13]. Все пациенты, как правило, имеют факторы риска, при этом летальность может достигать 26% [14][15]. Среди новорожденных это недоношенные или младенцы с тяжелой соматической или хирургической патологией. Одними из наиболее важных факторов риска являются наличие центрального венозного катетера (ЦВК) [16], септицемия, обезвоживание, асфиксия в родах, наследственная тромбофилия. Значительная доля ТЭЛА в младенчестве связана с врожденными пороками сердца и/или кардиохирургическими операциями. В подростковом возрасте практическое значение имеют следующие факторы риска: ожирение (47–52%), аутоиммунные заболевания (19%), онкология (8%), неподвижность (22%), сердечно-сосудистые заболевания (27%), инфекция (27%), хирургическое вмешательство (27%), анатомические аномалии (20%), табачный дым (6%), гормональная терапия для контрацепции, смена пола (6–22%), травма (3%), наследственная тромбофилия (19%), другие заболевания (11%), обезвоживание, системная красная волчанка и длительное общее парентеральное питание [17][18]. В двух представленных наблюдениях прием эстроген-гестагенов в одном случае и врожденная коагулопатия в другом явились, по нашему мнению, основными факторами риска развития ТЭЛА у девочек-подростков.
Несколько иные данные о распространенности тромбоэмболии были получены коллегами Мичиганского университета после изучения всех аутопсий за 25-летний период и анализа всех случаев ТЭЛА у младенцев и детей в возрасте от 0 до 19 лет, всего 119 пациентов [19]. Распределение по полу было одинаковым, а средний возраст составил 8,0 года. Возраст сам по себе не был независимым фактором риска развития ТЭЛА. По результатам проведенного анализа были идентифицированы следующие значимые факторы риска: шунтированная гидроцефалия (15,2%), случайная травма (8,4%), порок сердца (4,5%), инфекции (4,4%), неоплазии (4,0%) и общее заболевание (1,8%). В группе с неоплазией дети с солидными опухолями были подвержены повышенному риску развития ТЭЛА (6,7% пациентов) по сравнению с группой лимфолейкозов (2,6%). У 40% детей были диагностированы венозные тромбозы; однако подвздошно-бедренный венозный тромбоз наблюдался нечасто. ТЭЛА была признана клинически значимой в 30%, однако только у 50% из них имелись задокументированные признаки и симптомы эмболии и прижизненный диагноз был поставлен только у трети этих пациентов [20].
Анализ имеющихся данных литературы свидетельствует о том, что среди клинических симптомов ТЭЛА у детей самый распространенный — это одышка, встречается более чем в половине случаев (56,2%) [9]. Реже это боли в груди, кашель, кровохарканье, обмороки, тахикардия, гипоксия и лихорадка [21][22], что продемонстрировали обе наши пациентки.
Когортные исследования ТЭЛА в детском возрасте показывают «позднюю диагностику» данного заболевания, в среднем 7 дней от момента появления симптомов [23]. В наших клинических наблюдениях этот период был еще больше — 2 и 3 недели соответственно.
Среди методов диагностики ТЭЛА у детей стандартные кардиологические методы обследования редко несут в себе большую диагностическую ценность. Выраженные изменения на ЭКГ — перегрузка правых отделов сердца (cor pulmonale), блокада правой ножки пучка Гиса, изменение электрической оси сердца (отклонение вправо), так же как и дилатация правого желудочка, парадоксальное движение межжелудочковой перегородки, повышение давления в легочной артерии по данным ЭхоКГ, могут регистрироваться в острой фазе ТЭЛА и отсутствовать в более поздние сроки, как это и было в наших клинических наблюдениях [24][25]. Во взрослой кардиологической практике длительное сохранение указанных изменений на ЭКГ и ЭхоКГ отражает неблагоприятный прогноз ТЭЛА, однако такой строгой корреляции у пациентов детского возраста пока не отмечено.
Компьютерная ангиография по причине своей высокой чувствительности (90%) и специфичности (95%) практически полностью заменила радионуклидную сцинтиграфию, изучавшую вентиляционно-перфузионные соотношения при ТЭЛА. Рассчитываемый по КТ-ангиографии индекс поражения сосудистого русла (индекс Миллера) отражает тяжесть перенесенной ТЭЛА и прогноз [26][27][28]. Однако эти данные пока не изучены на педиатрической популяции пациентов.
Говоря о лабораторной диагностике ТЭЛА, следует отметить, что такие биомаркеры, как тропонин, NT pro-BNP, МВ-КФК, могут служить для определения прогноза ТЭЛА, но не являются важным диагностическим атрибутом [29][30].
В представленных нами клинических случаях данные лабораторные показатели были в пределах нормы, что свидетельствовало об отсутствии повреждения миокарда и скрытой хронической сердечной недостаточности на момент обследования девушек в клинике.
Согласно рекомендациям Международного общества по тромбозу и гемостазу, все дети с тромбозами должны быть обследованы на тромбофилию. Однако роль тромбофилии в определении рисков, тактики лечения и прогноза при ТЭЛА еще точно не определена для детей [31]. Изучение данных лабораторных показателей у девушки 14 лет обнаружило снижение уровня протеина С и S, что наиболее вероятно явилось причиной ТЭЛА. Исследование свертывающей системы крови (определение уровня D-димера, ПТИ, фибриногена, АТ-III) является обязательным, поскольку позволяет выявить не только имеющиеся нарушения гемостаза, но и выстроить правильную схему лечения и профилактики венозных тромбозов. Повышение уровня D-димера более чем в 4 раза было обнаружено у одной из девушек 17 лет, получавшей комбинированную терапию эстроген-гестагенными препаратами, усиливающими продукцию прокоагулянтов в печени и повышающими риск развития венозных тромбозов.
Заключение
За более чем 25-летний период общая частота возникновения ТЭЛА не изменилась. Наше сообщение акцентирует внимание на том обстоятельстве, что ТЭЛА встречается у детей с большей частотой, чем принято считать. Наличие в подростковом возрасте значимых факторов риска — прием гестаген-¬эстрогенных препаратов, врожденной тромбофилии, особенно при таких внезапно появившихся клинических симптомах, как одышка, боль в грудной клетке, кашель, кровохарканье — должно насторожить практикующих врачей на возможную ТЭЛА.
Список литературы
1. Gesammelte Abhandlungen zur wissenschaftlichen Medizin. Front Cover. Rudolf Virchow, Virchow. Meidinger John & Josep, 1856; 1024 p.
2. Riedel M. Acute pulmonary embolism: pathophysiology, clinical presentation, and diagnosis. Heart. 2001;85:229–240.
3. von Löschner J.W.F. Phlebitis venae cruralis sinistrae, periet myocarditis, embolia et oedema pulmonum. Jahrb f Kenderh (1861) 4:6.2. J.R. Buck, R.H. Connors, W.W. Coon et al. Pulmonary embolism in children. Journal of Pediatric Surgery. June 1981;16(3):385–391.
4. Andrew M., David M., Adams M., Ali K., Anderson R., Barnard D., et al. Venous thromboembolic complications (VTE) in children: first analyses of the Canadian Registry of VTE. Blood. 1994;83:1251–1257.
5. Biss T.T., Brandão L.R., Kahr W.H., Chan A.K., Williams S. Clinical features, and outcome of pulmonary embolism in children. Br J Haematol. 2008;142:808–818.
6. van Ommen C.H., Heijboer H., Büller H.R., et al. Venous thromboembolism in childhood: a prospective two-year registry in the Netherlands. J Pediatr. 2001;139:676–681.
7. Stein P.D., Kayali F., Olson R.E. Incidence of venous thromboembolism in infants and children: data from the National Hospital Discharge Survey. J Pediatr. 2004;145:563–565.
8. Dijk F.N., Curtin J., Lord D., Fitzgerald D.A. Pulmonary embolism in children. Paediatr Respir Rev. 2012;13:112–122.
9. Ariel de Siqueira Lira L., Celeste D.M., Garanito M., et al. Pulmonary embolism in pediatrics: A 10year experience from a tertiary center in Brazil. Hematol transfus cell ther. 2023;45(S2):85−90.
10. Wells P.S., Ginsberg J.S., Anderson D.R. et al. Use of a clinical model for safe management of patients with suspected pulmonary embolism. Ann Intern Med. 1998;129:997.
11. Klok F.A., Mos I.C.M., Nijkeuter M., et al. Simplifi cation of the revised Geneva score for assessing clinical probability of pulmonary embolism. Arch Intern Med. 2008; 168:2131–2136.
12. Kline J.A., Courtney D.M., Kabrhel C., et al. Prospective multicenter evaluation of the pulmonary embolism rule-out criteria. J Th romb Haemost. 2008; 6:772–780.
13. Stein P.D., Kayali F., Olson R.E. Incidence of venous thromboembolism in infants and children: data from the National Hospital Discharge Survey. J Pediatr. 2004;145:563–565.
14. Agha B.S., Sturm J.J., Simon H.K., et al. Pulmonary embolism in the pediatric emergency department. Pediatrics. 2013;132:663–667.
15. Biss T.T. Pulmonary embolism in childhood: how can we be sure not to miss it? Arch Dis Child. 2018;103:814–816.
16. Marcì M., Castiglione M.C., Sanfi lippo N. Pulmonary embolism in children: a report of two cases. J Cardiol Curr Res. 2016;5(3).
17. Stein P.D., Kayali F., Olson R.E. Incidence of venous thromboembolism in infants and children: data from the National Hospital Discharge Survey. J Pediatr. 2004;145(4):563–565.
18. Maggio A., Altieri L., Pantaleo D., Grignani M., et al. Pulmonary embolism in children, a real challenge for the pediatrician: a case report and review of the literature. Acta Biomed. 2022;93(3):1–6.
19. Buck J.R., Connors R.H., Coon W.W., Weintraub W.H., Wesley J.R., Coran A.G. Pulmonary embolism in children. J Pediatr Surg. 1981;16:385–391.
20. Urooj Zaidi A., Hutchins K.K. and Rajpurkar M. Pulmonary embolism in Children. Frontiers in Pediatrics. August 2017;5:1–8.
21. Brandao L.R., Labarque V., Diab Y., Williams S., et al. Pulmonary embolism in children. Semin Th romb Hemost. 2011;37:772–785.
22. Bernstein D., Coupey S., Schonberg S.K. Pulmonary embolism in adolescents. Am J Dis Child. 1986;140:667–671.
23. Rajpurkar M., Warrier I., Chitlur M., Sabo C., Frey M.J., Hollon W., et al. Pulmonary embolism-experience at a single children’s hospital. Thromb Res. 2007;119:699–703.
24. McGinn S., White P.D. Acute cor pulmonale resulting from pulmonary embolism. J Am Med Assoc 1935;104:1473.
25. Gleason M.M., White M.G., Myers J.L. Echocardiographic diagnosis of pulmonary embolism in childhood. J Am Soc Echocardiogr. 1995;8:100–102.
26. Stein P.D., Fowler S.E., Goodman L.R., et al. Multidetector computed tomography for acute pulmonary embolism. N Engl J Med. 2006;354(22):2317–2327.
27. Thacker P.G., Lee E.Y. Pulmonary embolism in children. AJR Am J Roentgenol. 2015;204:1278–1288.
28. Hiroyuki Tajima, Tadashi Kaneshiro, Naoko Takenoshita, et al. Endovenous Treatment for Acute Massive Pulmonary Thromboembolism. Annals of Vascular Diseases, Advance Published Date: October 30, 2017:1–6.
29. Dellas C., Puls M., Lankeit M., et al. Elevated hearttype fatty acid-binding protein levels on admission predict an adverse outcome in normotensive patients wiTh acute pulmonary embolism. J Am Coll Cardiol. 2010;55:2150–2157.
30. Lankeit M., Friesen D., Aschoff J., et al. Highly sensitive troponin T assay in normotensive patients wiThacute PE in Children. Eur Heart J. 2010;31:1836–1844.
31. Manco-Johnson M.J., Grabowski E.F., Hellgreen M., et al. Laboratory testing for thrombophiliain pediatric patients. On behalf of the Subcommittee for Perinatal and Pediatric Thrombosis of the Scientifi c and Standardization Committee of the International Society of Thrombosis and Haemostasis (ISTH). Thromb Haemost. 2002;88:155–156.
Об авторах
А. И. ДроздоваРоссия
П. Б. Хиштилова
Россия
Рецензия
Для цитирования:
Дроздова А.И., Хиштилова П.Б. Тромбоэмболия легочной артерии у двух девочек-подростков. Клинические случаи. Архив педиатрии и детской хирургии. 2025;3(1):69-76. https://doi.org/10.31146/2949-4664-apps-3-1-68-75
For citation:
Drozdova A.I., Hishtilova P.B. Pulmonary thromboembolism in two adolescent girls. Clinical cases. Archives of Pediatrics and Pediatric Surgery. 2025;3(1):69-76. (In Russ.) https://doi.org/10.31146/2949-4664-apps-3-1-68-75
JATS XML