Перейти к:
Возможности диагностики первичной цилиарной дискинезии в Российской Федерации
https://doi.org/10.31146/2949-4664-apps-3-2-5-15
Аннотация
Первичная цилиарная дискинезия (ПЦД) — орфанное заболевание (MIM 244400), чаще всего с аутосомно-рецессивным типом наследования, характеризующееся дисфункцией подвижных ресничек. Основными проявлениями ПЦД являются хронические заболевания верхних и нижних дыхательных путей, аномалии расположения органов, которые встречаются примерно у 50% пациентов с ПЦД (синдром Картагенера), врожденные пороки сердца, также характерно бесплодие у мужчин и склонность к внематочным беременностям у женщин.
Цель обзора — представить данные о современных методах диагностики ПЦД, которые возможны в Российской Федерации. Диагностика ПЦД является сложной задачей, так как нет единого «золотого стандарта», позволяющего полностью установить или исключить заболевание. Для точного определения ПЦД необходимо проводить ряд специализированных исследований, которые основываются на сочетании клинических данных, генетического анализа, а также анализа ультраструктуры и функции реснитчатого эпителия. Дополнительные тесты включают уровень оксида азота в выдыхаемом воздухе и повторные тесты в образцах культур ресничек. Педиатры, неонатологи, пульмонологи и оториноларингологи должны поддерживать высокую осведомленность о ПЦД и направлять пациентов в специализированные центры для подтверждения диагноза.
Ключевые слова
Для цитирования:
Кондратьева Е.И., Киян Т.А., Мельяновская Ю.Л. Возможности диагностики первичной цилиарной дискинезии в Российской Федерации. Архив педиатрии и детской хирургии. 2025;3(2):5-15. https://doi.org/10.31146/2949-4664-apps-3-2-5-15
For citation:
Kondratyeva E.I., Kiyan T.A., Melyanovskaya Yu.L. Possibilities and limitations in diagnosing primary ciliary dyskinesia in Russia. Archives of Pediatrics and Pediatric Surgery. 2025;3(2):5-15. (In Russ.) https://doi.org/10.31146/2949-4664-apps-3-2-5-15
Введение
Первичная цилиарная дискинезия (ПЦД) — это генетически гетерогенное заболевание, характеризующееся дефектами подвижных структур клеток (реснички, жгутики). В результате дефектов возникает нарушение подвижности ресничек, приводя к хроническим респираторным инфекциям, затяжным воспалительным процессам и ухудшению качества жизни пациентов. [1].
Кроме того, ПЦД может сопряжена с врожденными аномалиями, включая нарушения латерализации внутренних органов, что ведет к асимметрии в расположении органов, а также к проблемам с фертильностью у мужчин и женщин. Все это делает заболевание многоаспектным и требует комплексного подхода к диагностике и лечению, учитывающего его молекулярно-генетическую основу и клиническую вариабельность.
Распространенность ПЦД варьирует от 1:10 000 до 1:60 000. Однако в популяциях, где распространены кровнородственные браки, частота заболевания может быть значительно выше. Истинная распространенность ПЦД остается неопределенной, что в значительной степени объясняется недостаточной диагностикой. Широкий диапазон частоты заболевания обусловлен различиями в критериях диагностики и популяционными факторами, такими как географические вариации мутаций и частота кровнородственных браков. К тому же для ПЦД, как и для многих других редких заболеваний, долгое время не существовало кода в Международной классификации болезней (МКБ), что затрудняло идентификацию случаев в различных базах данных (МКБ-10 — Q33.8 — Другие врожденные аномалии легкого). В настоящее время с введением МКБ 11-го пересмотра для ПЦД выделен код LA75.Y — Другие уточненные структурные аномалии развития легких. Также обозначены разные подтипы заболевания, такие как синдром Картагенера и ПЦД с пигментным ретинитом, который обычно диагностируется у взрослых пациентов [2][3]. Согласно международным исследованиям, диагностика ПЦД затруднена: 35% пациентов с симптомами ПЦД обращались за помощью более 40 раз, прежде чем они были направлены к специалистам для прохождения диагностических тестов. В Германии, например, около 30% пациентов обратились к врачам более 50 раз до установления диагноза ПЦД [4].
Недавнее исследование в России, проведенное в 2023–2024 гг., показало, что средний возраст постановки диагноза ПЦД у детей составляет 5 лет, что сопоставимо с данными из Европы [4]. В Японии этот возраст достигает 7,5 года, при этом у пациентов с синдромом Картагенера диагноз подтверждается значительно раньше — в среднем в 3,5 года. У взрослых средний возраст постановки диагноза составляет 18 лет [3][4].
Диагностика ПЦД представляет собой сложный процесс, поскольку не существует единого «золотого стандарта», который бы позволял с уверенностью подтвердить или опровергнуть это заболевание. В связи с этой особенностью для точной диагностики требуется проведение множества специфических исследований, что подчеркивает важность исследовательских центров [5][6]. Целевая группа специалистов в области ПЦД рекомендует осуществлять тестирование только в специализированных учреждениях, которые располагают ресурсами и опытом для адекватной интерпретации разнообразных диагностических данных. Это необходимо для установления диапазона нормальных значений и выявления отклонений (аномалий), связанных с ПЦД, что позволяет сравнивать полученные результаты с данными здоровых доноров. Среди методов диагностики ПЦД выделяется несколько широко используемых тестов, каждый из которых вносит свой вклад в общий диагностический процесс. Скрининговым тестом является измерение оксида азота (nNO) в выдыхаемом воздухе. Уровни nNO при ПЦД, как правило, значительно ниже нормальных значений, что делает этот тест важным для начального скрининга. Следующим методом является высокоскоростная видеомикроскопия (HSVA), которая позволяет анализировать частоту и характер биения ресничек (свежие биообразцы и/или культуры клеток (Air-Liquid Interface — ALI). Такое исследование дает возможность выявить функциональные аномалии, свойственные ПЦД, и в сочетании с другими имеет высокую чувствительность и специфичность. Для исследования необходим образец клеток дыхательных путей, который затем исследуется под микроскопом с видеорегистрацией.
Трансмиссионная электронная микроскопия (TЭM) предоставляет возможность рассмотреть структуру ресничек на клеточном уровне. С помощью ТЭМ диагностируются структурные дефекты и отсутствие определенных компонентов в аксонеме реснитчатого эпителия [7].
Кроме того, существует метод иммунофлуоресцентного окрашивания (ИФ-окрашивание), который используется для выявления специфических структурных белков в ресничках. Данный метод предоставляет дополнительную информацию о наличии или отсутствии определенных белков, что также может способствовать диагностике [7][8].
Генотипирование становится не менее важным, поскольку позволяет идентифицировать мутации в генах, ассоциированных с ПЦД. Генетическое тестирование помогает подтвердить диагноз и выявить конкретные мутации для дальнейшего лечения и наблюдения пациентов [8].
Несмотря на то что доступность и возможность сочетания этих тестов варьируются в разных странах, руководящие принципы в области диагностики ПЦД обеспечивают определенную гибкость относительно выбора конкретных тестов для каждого пациента. В идеале специализированные центры должны иметь возможность предоставлять все необходимые тесты, которые способствуют диагностическому решению. Это позволяет врачам наилучшим образом адаптировать диагностику к каждому отдельному случаю и повышает вероятность правильного диагноза и дальнейшего эффективного лечения пациентов с ПЦД [9].
Методы диагностики ПЦД, которые используют в Российской Федерации
При установлении диагноза учитывается характерная клиническая картина проявления ПЦД, проводится оценка анамнестических данных с помощью предиктивной шкалы PICADAR (PrImary CiliAry DyskineseA Rule), которая указывает на необходимость дальнейшего диагностического поиска у детей с продуктивным кашлем (чувствительность и специфичность суммы баллов >5 для установления диагноза ПЦД — 90 и 75% соответственно) [10].
Основные клинические проявления ПЦД начинаются еще в период новорожденности в виде респираторного дистресс-синдрома и врожденной пневмонии, одним из серьезных осложнений которых является дыхательная недостаточность, с необходимостью подачи дополнительного кислорода в течение первых дней жизни. В дальнейшем ПЦД проявляется в виде рецидивирующих воспалительных заболеваний как верхних, так и нижних дыхательных путей, включая бронхиты и пневмонии, которые могут привести к образованию бронхоэктазов.
Статистика показывает, что респираторные симптомы осложняют течение первого месяца жизни у 60% пациентов с ПЦД. Также распространены хронический риносинусит, полипоз носа и рецидивирующие отиты, что может приводить к прогрессирующему снижению слуха. В некоторых случаях у детей раннего возраста наблюдаются симптомы, связанные с цефалгией, которые могут проявляться в виде капризности и снижением общего самочувствия, часто возникая на фоне хронического ринита и поражения придаточных пазух носа. Одним из проявлений ПЦД является гидроцефалия, которая связана с нарушением функции эпендимальных ресничек, выстилающих желудочки головного мозга. При этом ряд других врожденных аномалий, таких как транспозиция магистральных сосудов, сердечные аномалии, могут ассоциироваться с ПЦД [11]. Осложнения, связанные с ЛОР-органами, возникают в результате нарушения функции ресничек в евстахиевой трубе и среднем ухе и приводят к развитию хронического экссудативного среднего отита и рецидивирующим эпизодам острого среднего отита. Такие состояния могут вызывать кондуктивную тугоухость в раннем детском возрасте.
Кроме того, у 40–50% пациентов с ПЦД наблюдается обратное расположение внутренних органов (situs viscerum inversus) или изолированная декстрокардия [12]. Поэтому тщательно собранный анамнез позволяет педиатру выявить ключевые симптомы и синдромы, определить круг возможных диагнозов и спланировать дальнейшее обследование.
Дополнительному обследованию подлежат пациенты, имеющие несколько из перечисленных признаков:
- постоянный продуктивный кашель, аномалии расположения внутренних органов;
- врожденные пороки сердца;
- персистирующий ринит, полипозный риносинусит;
- хронический средний отит со снижением слуха (или без такового);
- повторные бронхиты, пневмонии в анамнезе;
- бронхоэктазы;
- наличие респираторных нарушений (в т. ч. при которых потребовалась интенсивная терапия) в периоде новорожденности;
- пациенты без аномалий расположения внутренних органов, но имеющие другие характерные клинические проявления ПЦД;
- сибсы и другие родственники пациентов с ПЦД, особенно при наличии характерных клинических проявлений;
- пациенты с сочетанием характерных клинических признаков с положительным результатом оценки по шкале PICADAR(> 5).
Для диагностики ПЦД используют рутинные методы с целью оценки и динамического контроля состояния респираторной и сердечно-сосудистой систем:
- спирометрия;
- рентгенография и компьютерная томография (КТ) органов грудной клетки и придаточных пазух носа;
- электрокардиография и эхокардиография;
- бронхоскопия;
- микробиологическая диагностика.
Центры РФ, в которых проводится лабораторная и инструментальная диагностика ПЦД
Высокотехнологичные диагностические тесты являются достаточно дорогостоящими и недоступны для широкого использования в неспециализированных центрах, поэтому в Российской Федерации диагностика ПЦД осуществляется в нескольких центрах: ФГБНУ «Медико-генетический научный центр имени академика Н.П. Бочкова» (г. Москва), ГБУЗ Московской области «НИКИ детства Министерства здравоохранения Московской области» (МО, г. Мытищи), НИКИ педиатрии и детской хирургии имени академика Ю.Е. Вельтищева (г. Москва), ФГАУ «НМИЦ здоровья детей» Минздрава России (г. Москва), ГБУЗ «Морозовская детская городская клиническая больница» (г. Москва) и ФГБУ «Национальный медицинский исследовательский центр им. В.А. Алмазова» Минздрава России (г. Санкт-Петербург).
Высокоскоростной видеомикроскопический анализ
Пациентам с клиническими признаками ПЦД рекомендовано проведение высокоскоростного видеомикроскопического анализа (ВСВМ; high-speed videomicroscopy analysis — HSVA или HSVMA) с целью оценки функциональной активности ресничек в щеточных свежих биоптатах слизистой носа, трахеи и/или бронхов или в ALI-культурах (только в ФГБНУ «МГНЦ»). Щеточные биоптаты получают с малоизмененной слизистой оболочки в период ремиссии заболевания (рекомендуется забор биоптата не ранее чем через 4–6 недель после острой респираторной инфекции).
На базе ФГБНУ «МГНЦ» высокоскоростной видеомикроскопический анализ проводится со скоростью съемки 180 кадров в секунду. Полученные видеоизображения анализируются с помощью разработанной программы определения частоты биения реснитчатого эпителия в Гц при первичной цилиарной дискинезии (Primary Ciliary Dyskinesia High-Speed Video Microscopy Analysis — PCD HSVMA). Исследование проводится на базе ФГБНУ «МГНЦ» всем пациентам при наличии показаний [13].
На базе НИКИ педиатрии и детской хирургии имени академика Ю.Е. Вельтищева проводится оценка функции цилиарного эпителия биоптатов слизистой оболочки носа или бронхов методом компьютеризированной световой микроскопии. Оцениваются такие параметры: двигательная активность ресничек при увеличении ×100, ×400, ×1000, процент клеток с подвижными ресничками в цельных пластах, характер движения ресничек, частота движения ресничек (Гц), морфологические особенности клеток цилиарного эпителия [14].
Исследование двигательной активности ресничек цилиарного эпителия в нативном препарате выполняется на базе Морозовской детской городской клинической больницы с помощью видеокомплекса, состоящего из микроскопа и цифровой высокоскоростной видеокамеры с возможностью съемки со скоростью до 200 кадров в секунду («ЕС-Экспертс», Россия), персонального компьютера с программным обеспечением MMC MultiMeter (MMCSoft, Россия). Проводится оценка частоты и паттерна биения ресничек (Гц) (синхронность биения, характер движения и амплитуда биения ресничек) [15].
Метод высокоскоростной видеомикроскопии используется в Национальном медицинском исследовательском центре им. В.А. Алмазова» (г. Санкт-Петербург). С целью объективной оценки активности цилиарного аппарата применяется метод видеоцитоморфометрии с использованием микроскопа для регистрации пяти видеофайлов с частотой записи 70–100 кадров в секунду. Морфометрический анализ полученных результатов осуществлялся посредством программного обеспечения MMC Multimeter software (MMCSoft, Russia). Нативный образец реснитчатого эпителия окрашивается гематоксилином Гарриса по Папаниколау и эозин-метиленовым синим по Май — Грюнвальду. В ходе видеоцитоморфометрии удается зарегистрировать такие параметры, как доля клеток с подвижными цилиями (%), выживаемость клеток (мин), частота биения цилий (ЧБЦ) (Гц), длина цилий (мкм) [16].
В ФГАУ «НМИЦ здоровья детей» Минздрава России проводится световая микроскопия реснитчатого эпителия респираторного тракта для записи видео и визуальной оценки подвижности ресничек эпителия дыхательных путей [17].
Самостоятельно метод высокоскоростной видеомикроскопии не может быть использован и имеет диагностическое значение при использовании совместно с оценкой клинических симптомов и другими специальными методами.
Европейское респираторное общество (European Respiratory Society — ERS) не рекомендует оценивать частоту биений ресничек (CBF) без оценки характера биения ресничек при диагностике ПЦД. Для повышения диагностической точности высокоскоростной видеомикроскопии оценку биения следует повторить после ALI-культивирования клеток мерцательного эпителия.
Цилиогенез клеток назального эпителия человека in vitro
Цилиогенез культур клеток назального эпителия, полученных от пациентов с ПЦД, проводится методом ALI-культивирования и помогает в подтверждении диагноза, избегая при этом проблем с ложноположительным диагнозом при вторичных повреждениях респираторного эпителия. Данное исследование осуществляется только на базе ФГБНУ «МГНЦ» всем пациентам при наличии показаний [18].
Трансмиссионная электронная микроскопия (ТЭМ) используется для оценки ультраструктурных дефектов аксонемы. При фенотипических признаках, позволяющих предполагать наличие ПЦД, с помощью ТЭМ исследуются реснитчатые клетки назального эпителия. Метод является обязательным для диагностики ПЦД согласно европейским и американским критериям заболевания.
ТЭМ имеет 100% специфичность, но не всегда чувствительна. Согласно европейским исследованиям, у 10–20% пациентов с диагнозом ПЦД, установленным с помощью других методов, в том числе молекулярно-генетического обследования, обнаруживается нормальная ультраструктура аксонемы ресничек либо недиагностируемая аномалия (при некоторых генетических вариантах). Учитывая этот факт, сделан вывод, что метод обладает высокой специфичностью, но ограниченной чувствительностью (рис. 1).
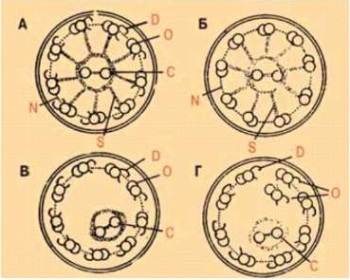
Рисунок 1.
Схема ультраструктурных изменений аксонемы реснички слизистой респираторного тракта при ПЦД (по Cox D.W. and Talamo R.C., 1979)
Примечание: А — нормальное строение реснички. Б, В, Г — изменения при ПЦД: отсутствие динеиновых ручек (Б), радиальных спиц (В, Г), изменение числа и транслокация микротрубочек (В, Г). D — динеиновые ручки; N — нексиновыe связки; S — радиальные спицы; С — центральная пара микротрубочек; О — наружные микротрубочки.
Figure 1.
Changes in ciliary axoneme ultrastructure in PCD (according to Cox D.W. and Talamo R.C., 1979)
Note: A — normal ciliary ultrastructure. Б, В, Г — changes in PCD: absence of dynein arms (Б), radial spokes (В, Г), change in the number and translocation of microtubules (В, Г). D — dynein arms; N — nexin links; S — radial spokes; C — central pair of microtubules; O — outer microtubules.
Мальчикам с ПЦД после 15 лет проводится андрологическое обследование с проведением стандартного спермиологического исследования (анализ спермограммы) и электронной микроскопии сперматозоидов (ЭМИС). Оба метода — ТЭМ и ЭМИС — доступны только в ФГБНУ «МГНЦ» [7][9][12].
Нарушение структуры ресничек при первичной цилиарной дискинезии
Варианты в генах, кодирующих аксонемную структуру и дополнительные компоненты ресничек, могут приводить к дефектам ультраструктуры, а другие — к аномальной функции, но с сохранением ультраструктуры.
При фенотипических признаках, позволяющих предполагать наличие ПЦД, с помощью ТЭМ исследуются реснитчатые клетки назального или трахеального или бронхиального соскоба. Наиболее распространенными ультраструктурными дефектами, идентифицированными в респираторных ресничках пациентов с ПЦД, являются отсутствие, частичное отсутствие или укорочение наружных и/или внутренних динеиновых ручек (рис. 2 А–C). Другие дефекты включают полное или частичное отсутствие центральной пары микротрубочек, иногда сопровождающееся изменениями положения или формы внешних дуплетов микротрубочек (рис. 2 D–F), различные нарушения микротрубочек, связанные с дефектами регуляторного комплекса нексин-динеин и радиальных спиц.
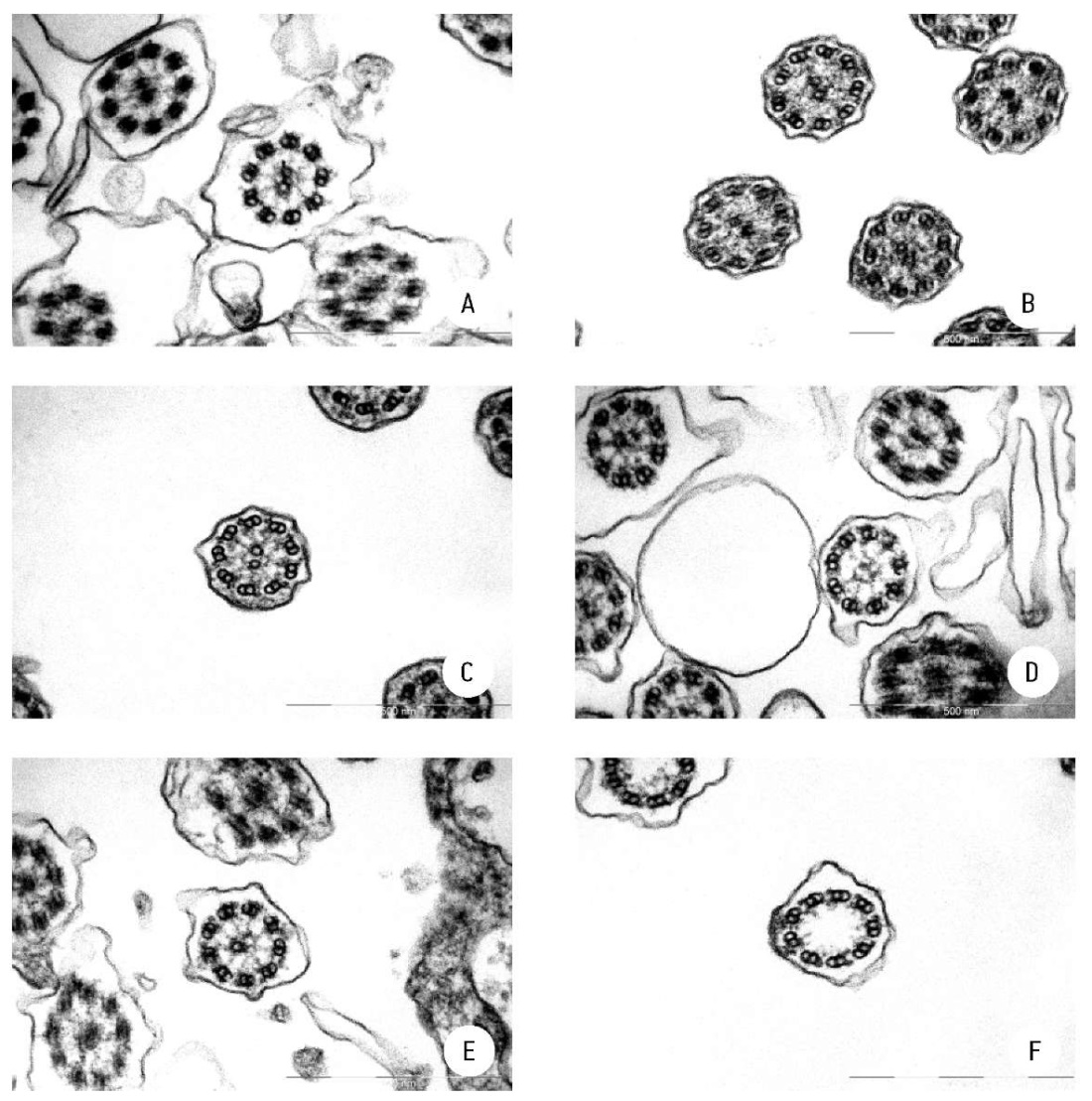
Рисунок 2.
Поперечные срезы через реснички с аномальной структурой динеиновых ручек аксонемы
Примечание: A — отсутствие наружных и внутренних динеиновых ручек; B — нарушение структуры радиальных спиц аксонемы и отсутствие внутренних динеиновых ручек; C — внутренние динеиновые ручки выявляются у 2, 6, 7 и 8-го дуплетов микротрубочек. Возможный вариант нормы; D — отсутствие центральной пары микротрубочек при сохранении центральной капсулы. Неполные микротрубочки А части периферических дуплетов; E — одна непарная микротрубочка в центре. Неполные микротрубочки А части периферических дуплетов; F — полное отсутствие центрального аппарата аксонемы (капсулы и центральных микротрубочек).
Figure 2.
Cross-sections through cilia with abnormal structure of axonemal dynein arms
Note: A — absence of outer and inner dynein arms; B — defective radial spokes of axoneme and absence of inner dynein arms; C — inner dynein arms detected in 2, 6, 7 and 8 microtubule doublets. Possible normal variant; D — absence of central pair of microtubules with preserved central sheath. Incomplete A subtubules of peripheral doublets; E — one single microtubule in the center. Incomplete A subtubules of peripheral doublets; F — complete absence of central apparatus of axoneme (sheath and central microtubules).
Метод иммунофлуоресцентного окрашивания (ИФ-окрашивание)
Только на базе ФГБНУ «МГНЦ» проводится иммунофлуоресцентное окрашивание ресничек методом ALI-культивирования на маркер реснитчатых клеток (β-тубулин) и маркеры основных классов ультраструктурных дефектов ресничек (DNAH5, CFAP300, DNAH11, HYDIN, CCDC103), наблюдаемых при ПЦД в РФ. По флуоресцентным изображениям, после иммунофлуоресцентного окрашивания на маркеры DNAH5, DNAH11, HYDIN и CFAP300 визуально должны наблюдаться различия в окрашивании между здоровым донором и пациентами с ПЦД (рис. 3).
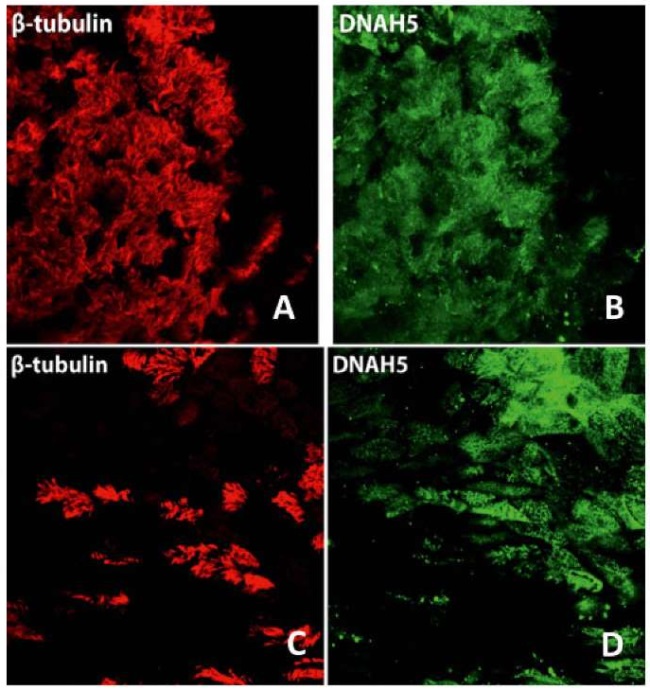
Рисунок 3.
Флуоресцентные изображения ресничек в ALI-культуре на 24‑й день цилиогенеза in vitro: A, B — у здорового донора; C, D — у пациента с ПЦД. Положительное окрашивание на β-тубулин (А) и положительное окрашивание на DNAH5 (B) × 100 у здорового донора; снижение окрашивания на β-тубулин (С) и DNAH5 (D) у пациента с ПЦД
Figure 3.
Fluorescent microscopy of cilia in ALI culture at day 24 of in vitro ciliogenesis: A, B — in a healthy donor; C, D — in a patient with PCD. Positive staining for β-tubulin (A) and positive staining for DNAH5 (B) × 100 in a healthy donor; decreased staining for β-tubulin (C) and DNAH5 (D) in a patient with PCD
Генетические исследования
В большинстве случаев ПЦД наследуются по аутосомно-рецессивному типу, за исключением FOXJ1 (который является аутосомно-доминантным) и PIH1D3 и OFD1 (которые являются X-сцепленными). Описано более 60 различных генов, вызывающих ПЦД, включая дефекты в наружных динеиновых ручках аксонемы (DNAH5, DNAH9, DNAH12, DNAI1, ARMC4, CCDC103), внутренних динеиновых ручках (DNALI1), сборочных белках (DNAAF3) и радиальных белках, спицах (RSPH4A, RSPH9). В семьях могут быть разные мутировавшие гены, но идентичные клинические симптомы. На портале OMIM (http://www.omim.org/) к настоящему времени указано 45 генетических локусов, участвующих в реализации ПЦД. Тем не менее 20–30% людей с хорошо охарактеризованной ПЦД не имеют идентифицируемых патогенных вариантов ни в одном из известных генов.
В силу генетической гетерогенности предпочтительным является следующий алгоритм проведения исследований:
- комплексное геномное тестирование (секвенирование экзома, секвенирование генома);
- сегрегационный анализ в семье для уточнения наличия мутаций у близких родственников пациента;
- функциональный анализ для опровержения или подтверждения патогенности генетического варианта (кровь или фибробласты). Проводится в ФГБНУ «МГНЦ» всем пациентам при наличии показаний;
- анализ MLPA(Multiplex Ligation-dependent Probe Amplification) — мультиплексная лигазная зондовая амплификация протяженных изменений в генах (делеций / дупликаций), поскольку простое секвенирование не идентифицирует такой тип изменений.
Диагностически значимым считается выявление биаллельной мутации (гомозиготной или компаунд-гетерозиготной при рецессивном типе наследования). К настоящему моменту наличие патогенных вариантов нуклеотидной последовательности выявлено лишь у 50–75% пациентов с ПЦД.
В диагнозе целесообразно указывать генотип пациента [19][20][21].
В проекте клинических рекомендациях 2024 г. прописано, что генетический анализ у пациентов с ПЦД с целью верификации диагноза и установления конкретной генетической формы рекомендован, и современные данные показывают, что установление генетического диагноза очень важно при подборе таргетной терапии и планировании семейной жизни [7][22].
Многие частные генетические лаборатории, к примеру «Геномед» (https://genomed.ru/), ПАО «ЦГРМ «ГЕНЕТИКО» (https://genetico.ru/), ООО «Лаборатория Гемотест» (https://gemotest.ru/), ООО «Инвитро» (https://www.invitro.ru/), МГНЦ ФГБНУ «МГНЦ» (https://med-gen.ru/), лаборатория ФГАУ «НМИЦ здоровья детей» Минздрава России (https://nczd.ru/), на платной основе могут провести анализ экзома (стоимость исследования варьируется от 40 000 до 70 000 руб.) или генома (стоимость исследования варьируется от 80 000 до 190 000 руб.). Продолжительность исследования также варьируется; так, например, анализ экзома могут провести в части лабораторий за 45 дней, в то время как в других лабораториях время исследования доходит до 6 месяцев. В среднем исследование экзома можно провести за 3 месяца, а генома — за 6 месяцев.
На сегодня в ФГБНУ «МГНЦ» в рамках фундаментального научного исследования, обозначенного как «Комплексный анализ гено-фенотипических корреляций при муковисцидозе и первичной цилиарной дискинезии», для пациентов проводится бесплатная ДНК-диагностика по поиску генетических вариантов, ответственных за развитие заболевания. Пациентам проводится весь спектр современных исследований для постановки более полного диагноза.
Дифференциально-диагностический поиск включает: муковисцидоз, первичные иммунодефицитные состояния, врожденные аномалии строения бронхиального дерева, бронхоэктазы другого происхождения, бронхиальную астму, ряд врожденных аномалий сердечно-сосудистой системы: транспозицию магистральных сосудов и т. п. Цилиарная дисфункция может также быть причиной других состояний, таких как поликистоз печени и/или почек, атрезия желчных путей, ретинопатия, которые могут протекать без респираторных проявлений и нередко расцениваются как самостоятельные генетические синдромы (Сениора — Локена, Альстрёма, Бардет — Бидля) в связи с этим важно подтвердить диагноз с помощью генетического исследования.
Заключение
Высокотехнологичные диагностические тесты, такие как генетические исследования и специализированные функциональные тесты, остаются достаточно дорогостоящими и оказываются недоступными для использования в неспециализированных медицинских учреждениях. Поэтому для оптимизации процесса диагностики ПЦД целесообразен отбор пациентов, нуждающихся в углубленном обследовании и направлении в ряд центров, которые есть в Москве и Санкт-Петербурге.
Процесс отбора начинается с анамнестических данных, анализа клинических симптомов, результатов предварительных обследований, которые могут указывать на наличие первичной цилиарной дискинезии.
Знания о течении и возможностях диагностики ПЦД помогут специалистам целенаправленно определять группы пациентов с высоким риском наличия ПЦД и направлять их на проведение высокотехнологичных диагностических тестов, что в итоге может привести к более точной диагностике и проведению эффективного лечения. Для записи и получения более подробной информации для пациентов и врачей на базе ФГБНУ «МГНЦ» создана электронная почта: pcd_rf@mail.ru.
Участие авторов / Author contribution
Е.И. Кондратьева — идея, подготовка текста статьи, координация работы авторской группы, утверждение окончательного варианта статьи.
Т.А. Киян — обзор литературы, написание и подготовка текста статьи
Ю.Л. Мельяновская — написание текста статьи.
Elena I. Kondratyeva — concept statement, preparing the manuscript, coordinating the authors, approving the final version of the paper.
Tatiana A. Kyian — literature review, preparing the manuscript.
Yuliya L. Melyanovskaya — preparing the manuscript.
Список литературы
1. Newman L., Chopra J., Dossett C., Shepherd E., Bercusson A., Carroll M., Walker W., Lucas J.S., Cheong Y. Th e impact of primary ciliary dyskinesia on female and male fertility: a narrative review. Hum Reprod Update. 2023 May 2;29(3):347–367. doi: 10.1093/humupd/dmad003. PMID: 36721921; PMCID: PMC10152180.
2. Кондратьева Е.И., Авдеев С.Н., Киян Т.А., Мизерницкий Ю.Л. Классификация первичной цилиарной дискинезии. Пульмонология. 2023;33(6):731–738. doi: 10.18093/0869-0189-2023-33-6-731-738.
3. Кондратьева Е.И., Авдеев С.Н., Мизерницкий Ю.Л., Поляков А.В., Чернуха М.Ю., Кондратенко О.В., Намазова-Баранова Л.С., Вишнева Е.А., Селимзянова Л.Р., Симонова О.И., Гембицкая Т.Е., Брагина Е.Е., Рачина С.А., Малахов А.Б., Поляков Д.П., Одинаева Н.Д., Куцев С.И. Первичная цилиарная дискинезия: обзор проекта клинических рекомендаций 2022 года. Пульмонология. 2022;32(4):517–538. doi: 10.18093/0869-0189-2022-32-4-517-538.
4. Behan L., Dunn Galvin A., Rubbo B., Masefi eld S., Copeland F., Manion M., Rindlisbacher B., Redfern B., Lucas J.S. Diagnosing primary ciliary dyskinesia: an international patient perspective. Eur Respir J. 2016 Oct;48(4):1096–1107. doi: 10.1183/13993003.02018-2015. Epub 2016 Aug 4. PMID: 27492837; PMCID: PMC5045441.
5. Shapiro A.J., Davis S.D., Polineni D., et al. Diagnosis of Primary Ciliary Dyskinesia. An Offi cial American Th oracic Society Clinical Practice Guideline. Am J Respir Crit Care Med. 2018;197(12):e24-e39. doi:10.1164/rccm.201805-0819ST.
6. Kuehni C.E., Lucas J.S. Diagnosis of primary ciliary dyskinesia: summary of the ERS Task Force report. Breathe. 2017;13(3):166–178. doi:10.1183/20734735.008517.
7. Lucas J.S., Barbato A., Collins S.A., Goutaki M., Behan L., Caudri D., Dell S., Eber E., Escudier E., Hirst R.A., Hogg C., Jorissen M., Latzin P., Legendre M., Leigh M.W., Midulla F., Nielsen K.G., Omran H., Papon J.F., Pohunek P., Redfern B., Rigau D., Rindlisbacher B., Santamaria F., Shoemark A., Snijders D., Tonia T., Titieni A., Walker W.T., Werner C., Bush A., Kuehni C.E. European Respiratory Society guidelines for the diagnosis of primary ciliary dyskinesia. Eur Respir J. 2017 Jan 4;49(1):1601090. doi: 10.1183/13993003.01090-2016. PMID: 27836958; PMCID: PMC6054534.
8. Raidt J.H. Analyses of 1236 genotyped primary ciliary dyskinesia individuals identify regional clusters of distinct DNA variants and signifi cant genotype-phenotype correlations. Eur Respir J. 2024 Aug 8;64(2):2301769. doi: 10.1183/13993003.01769-2023.
9. Lucas JS, Leigh MW. Diagnosis of primary ciliary dyskinesia: searching for a gold standard. Eur Respir J. 2014 Dec;44(6):1418-22. doi: 10.1183/09031936.00175614. PMID: 25435529, Lucas JS, Dimitrov BD, Behan L, Kuehni CE. Diagnostic testing in primary ciliary dyskinesia. Eur Respir J. 2016 Sep;48(3):960–1. doi: 10.1183/13993003.00909-2016. PMID: 27581415.
10. Behan L., Dimitrov B.D., Kuehni C.E., Hogg C., Carroll M., Evans H.J., Goutaki M., Harris A., Packham S., Walker W.T., Lucas J.S. PICADAR: a diagnostic predictive tool for primary ciliary dyskinesia. Eur Respir J. 2016 Apr;47(4):1103–12. doi: 10.1183/13993003.01551-2015. Epub 2016 Feb 25. PMID: 26917608; PMCID: PMC4819882.
11. Николаева Е.Д., Овсянников Д.Ю., Стрельникова В.А., Поляков Д.П., Тронза Т.В., Карпова О.А., Фатхуллина И.Р., Брагина Е.Е., Щагина О.А., Старинова М.А., Красовский С.А., Киян Т.А., Жекайте Е.К. Характеристика пациентов с первичной цилиарной дискинезией. Пульмонология. 2023;33(2):198–209. doi: 10.18093/0869-0189-2023-33-2-198-209.
12. Кондратьева Е.И., Авдеев С.Н., Киян Т.А., Мержоева З.М., Карпова О.А., Брагина Е.Е., Рыжкова О.П., Попова В.М., Старинова М.А., Черных В.Б. Сравнительная характеристика пациентов с первичной цилиарной дискинезией с наличием или без синдрома Картагенера. Пульмонология. 2024;34(2):194– 205. doi: 10.18093/0869-0189-2024-34-2-194-205.
13. Киян Т.А., Смирнихина C.А., Демченко А.Г., Вейко Р.В., Кондратьева Е.И. Новая компьютерная программа автоматизированного анализа движения цилиарного эпителия респираторного тракта для диагностики первичной цилиарной дискинезии. Пульмонология. 2024;34(2):184–193. doi: 10.18093/0869-0189-2024-34-2-184-193.
14. Новак А.А. Первичная цилиарная дискинезия: основные подходы к диагностике и лечению / Ю.Л. Мизерницкий, А.А. Новак. Пульмонология детского возраста: проблемы и решения. Выпуск 22. М.: ИД «МЕДПРАКТИКА-М». 2022. С. 26–33.
15. Стрельникова В.А., Овсянников Д.Ю., Пушков А.А., Айрапетян М.И., Брагина Е.Е., Булынко С.А., Воронкова А.Ю., Горев В.В., Григориадис Н.К., Гутырчик Т.А., Деева Е.В., Жилина С.В., Карпенко М.А., Колганова Н.И., Кондакова О.Б., Лаберко Е.Л., Малышев О.Г., Нафанаилова Э.А., Реминная А.С., Симонова О.И., Соколова Н.А., Старевская С.В., Топилин О.Г., Цверава А.Г., Шмелева И.О., Шубина Ю.Ф., Юшина Т.И., Савостьянов К.В. Первичная цилиарная дискинезия у детей: клиническая, лабораторно-инструментальная и генетическая характеристика. Педиатрия. Consilium Medicum. 2024;3:280–288. doi: 10.26442/26586630.2024.3.202914.
16. Алексеенко С.И., Дворянчиков В.В., Артюшкин С.А., Барашкова С.В., Аникин И.А., Исаченко В.С. Взаимосвязь между нарушениями цилиарного аппарата эпителия слизистой оболочки носа и тяжестью синоназальной патологии у детей с хроническим риносинуситом. Российская оториноларингология. 2022;21(1):8–18. doi: 10.18692/1810-4800-2022-1-8-18.
17. Симонова О.И., Селимзянова Л.Р., Симонова А.Ю., Горинова Ю.В., Кустова О.В., Лазарева А.В., Платонова М.М., Вишнева Е.А., Босенко Ю.А. Первичная цилиарная дискинезия (синдром Картагенера): случай поздней диагностики и катамнестическое наблюдение. Пульмонология. 2024;34 (2):248–256. doi: 10.18093/0869-0189-2024-34-2-248-256.
18. Демченко А.Г., Смирнихина С.А. Культуры реснитчатых клеток для диагностики первичной цилиарнои дискинезии. Пульмонология. 2023;33(2):210–215. doi: 10.18093/0869-0189-2023-33-2-210-215.
19. Handbook of Paediatric Respiratory Medicine. 1st Edition. E. Eber, F. Midulla. 2013 European Respiratory Society. 719 P.
20. Lucas J.S.A., Walker W.T., Kuehni C.E., Lazor R. European Respiratory Society Monograph Orphan Lung Diseases Edited by J-F. Cordier. Chapter 12. Primary ciliary dyskinesia. 2011;54: 201–217.
21. Shapiro A.J., Zariwala M.A., Ferkol T., Davis S.D., Sagel S.D., Dell S.D., Rosenfeld M., Olivier K.N., Milla C., Daniel S.J., Kimple A.J., Manion M., Knowles M.R., Leigh M.W. Genetic Disorders of Mucociliary Clearance Consortium. Diagnosis, monitoring, and treatment of primary ciliary dyskinesia: PCD foundation consensus recommendations based on state of the art review. Pediatr Pulmonol. 2015 Sep 29. doi: 10.1002/ppul.23304.
22. Primary ciliary dyskinesia (immotile-cilia syndrome) Sten-Erik Bergström, last updated: Feb 24, 2021 https://www.uptodate.com/contents/primary-ciliary-dyskine-siaimmotile-cilia-syndrome/print.
Об авторах
Е. И. КондратьеваРоссия
Кондратьева Елена Ивановна, д.м.н., профессор, руководитель научно-клинического отдела муковисцидоза; заместитель директора по научной работе
ул. Москворечье, д. 1, г. Москва, 115522
ул. Коминтерна, 24а, стр. 1, г. Мытищи, 115093
Т. А. Киян
Россия
Киян Татьяна Анатольевна, к.м.н., старший научный сотрудник научно-клинического отдела муковисцидоза; старший научный сотрудник научно-организационного отдела
ул. Москворечье, д. 1, г. Москва, 115522
ул. Коминтерна, 24а, стр. 1, г. Мытищи, 115093
Ю. Л. Мельяновская
Россия
Мельяновская Юля Леонидовна, к.м.н., старший научный сотрудник научно-клинического отдела муковисцидоза; ассистент кафедры клинической генетики и орфанных заболеваний
ул. Москворечье, д. 1, г. Москва, 115522
ул. Коминтерна, 24а, стр. 1, г. Мытищи, 115093
Рецензия
Для цитирования:
Кондратьева Е.И., Киян Т.А., Мельяновская Ю.Л. Возможности диагностики первичной цилиарной дискинезии в Российской Федерации. Архив педиатрии и детской хирургии. 2025;3(2):5-15. https://doi.org/10.31146/2949-4664-apps-3-2-5-15
For citation:
Kondratyeva E.I., Kiyan T.A., Melyanovskaya Yu.L. Possibilities and limitations in diagnosing primary ciliary dyskinesia in Russia. Archives of Pediatrics and Pediatric Surgery. 2025;3(2):5-15. (In Russ.) https://doi.org/10.31146/2949-4664-apps-3-2-5-15
JATS XML