Перейти к:
Клиническая значимость определения фекального кальпротектина у детей с целиакией: одномоментное исследование
https://doi.org/10.31146/2949-4664-apps-3-2-33-42
Аннотация
Актуальность. В последнее время большие надежды возлагаются на внедрение в практику результатов исследований, основанных на определении биологических маркеров воспаления, одним из которых является фекальный кальпротектин (ФК). В литературе имеются единичные сообщения по результатам определения ФК у больных с целиакией, причем полученные данные отличаются разнообразием показателей.
Цель исследования: определить клиническую значимость фекального кальпротектина при целиакии у детей, провести параллели между ФК и нарушением проницаемости тонкого кишечника.
Материалы и методы. В период с января 2018 г. по июнь 2019 г. обследовано 42 ребенка: 28 с впервые выявленной целиакией, 14 больных с ранее установленным диагнозом, соблюдавших аглютеновую диету, и 20 практически здоровых детей аналогичного возраста (контрольная группа). Всем детям проводилось определение антител к тканевой трансглутаминазе IgA и общего IgA (ИФА-метод). Измерение уровня ФК проводилось ИФА-методом. Использовался и неинвазивный способ определения проницаемости кишечной стенки (по методу В.И. Петрова и соавт., 2003 год).
Результаты. Исследования ФК продемонстрировали повышение его значений у детей с впервые установленным диагнозом — 36,6 ± 10,2 мкг/г по сравнению с контрольной группой (20,9 ± 8,7 мкг/г). В группе детей с рефрактерным течением заболевания показатели ФК были значительно выше, чем в группе до лечения и в контрольной группе: 77,9 ± 24 мкг/г. Результаты оценки состояния кишечного барьера по- казали, что у пациентов с целиакией отмечалось повышение проницаемости кишечной стенки по сравнению с контрольной группой из здоровых детей (0,3 ± 0,02 опт ед., p < 0,05), наиболее заметное при впервые установленной целиакией (-0,1 ± 0,05 опт ед.). Корреляционный анализ продемонстрировал прямую взаимосвязь между значениями ФК и проницаемостью тонкой кишки при рефрактерной целиакии (0,96).
Заключение. У детей с рефрактерным течением целиакии показатели ФК превышают значения здоровых детей и пациентов с первично диагностированным заболеванием. Выявлена высокая корреляционная связь между повышенными значениями ФК и проницаемостью кишечника у детей с рефрактерным течением заболевания.
Для цитирования:
Геллер С.И., Камилова А.Т., Умарназарова З.Е., Усманова К.Ш. Клиническая значимость определения фекального кальпротектина у детей с целиакией: одномоментное исследование. Архив педиатрии и детской хирургии. 2025;3(2):33-42. https://doi.org/10.31146/2949-4664-apps-3-2-33-42
For citation:
Geller S.I., Kamilova A.T., Umarnazarova Z.E., Usmanova K.Sh. Clinical implications of the determination of fecal calprotectin in children with celiac disease: A cross-sectional study. Archives of Pediatrics and Pediatric Surgery. 2025;3(2):33-42. (In Russ.) https://doi.org/10.31146/2949-4664-apps-3-2-33-42
Введение
Целиакия — иммуноопосредованное системное заболевание, которое возникает в ответ на употребление глютена или соответствующих проламинов генетически предрасположенными индивидуумами и характеризуется наличием широкой комбинации глютензависимых клинических проявлений, повышением в сыворотке концентрации специфических антител к тканевой трансглутаминазе (anti-tTG), к эндомизию (EMA), наличием HLA-DQ2 или HLA-DQ8-гаплотипов и энтеропатии [1][2]. Заболевание является достаточно распространенным и встречается примерно в 1% в западной популяции [3–5].
Данные о распространенности целиакии в азиатских странах значительно изменились в течение последних лет и сопоставимы с европейскими и североамериканскими. Так, целиакия выявлена у 6,5% детей с хронической диареей в Китае [6]. Японское исследование с участием 470 человек установило частоту встречаемости целиакии по данным серологии и биопсии у 1,6%, что соответствует мировой распространенности [7][8].
На данный момент диагностика целиакии базируется преимущественно на серологических исследованиях и гистологической оценке биоптатов слизистой оболочки тонкой кишки, полученных инвазивным методом. Однако, несмотря на существенный прогресс в области диагностических подходов, сохраняется ряд факторов, обусловливающих необходимость дальнейшего поиска и валидации новых биомаркеров, которые могли бы повысить точность диагностики и эффективность мониторинга пациентов с целиакией.
В последнее время большие надежды возлагаются на внедрение в практику результатов исследований, основанных на определении биологических маркеров воспаления, одним из которых является ФК [9–11].
Полученный непосредственно из кишечника, ФК объективно указывает на наличие или отсутствие воспаления, по его уровню также можно судить о степени выраженности воспалительного процесса. Кроме того, ФК является важным провоспалительным посредником в реакциях острого и хронического воспаления [12][13]. В современных исследованиях показана его высокая чувствительность, специфичность и прогностическая ценность при воспалительных заболеваниях кишечника, у недоношенных детей при угрозе развития некротизирующего энтероколита, колоректальном раке, нестероидной энтеропатии, алкогольной энтеропатии, хроническом панкреатите и циррозе печени [14–18].
В литературе имеются единичные сообщения о результатах определения ФК у больных с целиакией, причем полученные данные отличаются значительным разнообразием показателей [19][20]. В частности, Massimo Montalto и соавт. [21] не установили взаимосвязи между его значениями у пациентов с целиакией и контрольной группой. Авторы утверждают, что ФК не коррелирует с серьезностью клинических симптомов, степенью нейтрофильной инфильтрации или гистопатологическим повреждением. Ertekin V. и соавт. [22] утверждают, что у детей с целиакией повышение ФК связано с тяжестью гистопатологических изменений и чувствительностью к безглютеновой диете (БГД). Таким образом, к настоящему времени нет единых подходов о значении ФК при целиакии у детей.
Цель исследования: определение значимости ФК как предиктора неблагоприятного клинического течения и маркера нарушения проницаемости тонкого кишечника при целиакии у детей.
Материалы и методы
Проведено одномоментное исследование. С января 2018 г. по июнь 2019 г. проведено обследование пациентов с целиакией, госпитализированных в отделение гастроэнтерологии Республиканского специализированного научно-практического медицинского центра педиатрии МЗ РУз (Ташкент). Контрольную группу составили 20 практически здоровых детей аналогичного возраста. Несмотря на временной промежуток, полученные результаты остаются релевантными и отражают ключевые тенденции, сохраняющие актуальность в настоящее время.
Критерии включения:
- дети в возрасте 1–17 лет с целиакией и здоровые дети соответствующего возраста (возраст обследованных детей находился в диапазоне, для которого уровни ФК считаются стабильными и не зависят от возрастных физиологических колебаний);
- возможность проспективного наблюдения за пациентами (контроль состояния и приверженность диете детей с ранее установленным диагнозом).
Критерии невключения:
- наличие инфекционных и паразитарных заболеваний (лямблиоз, амебиаз);
- наличие воспалительных заболеваний кишечника (язвенный колит, болезнь Крона);
- наличие синдрома раздраженной кишки.
Диагноз «целиакия» устанавливали во время первой госпитализации детей на основании определения антител к тканевой трансглутаминазе IgA и общего IgA, генетических исследований: HLA DQ2 и/или DQ8, биопсии залуковичного отдела тонкой кишки [1]. Информацию о группе здоровья контрольной группы (здоровые дети) подтверждали на основании сведений истории развития ребенка.
Лабораторные исследования
Измерение уровня ФК проводилось с использованием набора Human Fecal Calprotectin производства фирмы HycultBiotech (Нидерланды) для количественного определения в образцах кала. Метод — твердофазный иммуноферментный анализ (одностадийный «сэндвич»-вариант). Образцы кала после предварительной обработки специальным экстракционным буфером замораживались и хранились при температуре –200 °С. При постановке анализа биотинилированные антитела захвата и конъюгированные с пероксидазой хрена меченные антитела будут связываться с кальпротектином, присутствующим в смеси стандарта и образца. Биотинилированные антитела захвата связываются с лунками, покрытыми стрептавидином, в комплексе со стандартом или образцами и конъюгированными с пероксидазой хрена мечеными антителами. Конъюгированное с пероксидазой хрена меченое антитело будет реагировать с субстратом, тетраметилбензидином (TMБ). Ферментативную реакцию останавливают добавлением щавелевой кислоты. Поглощение при длине волны 450 нм измеряется спектрофотометром. Стандартная кривая получается путем построения оптической плотности (линейной) по сравнению с соответствующими концентрациями стандартов кальпротектина (log). Концентрация кальпротектина образцов и контролей, которые запускаются одновременно со стандартами, может быть определена по стандартной кривой.
Оценку состояния кишечного барьера проводили с использованием неинвазивного способа определения проницаемости кишечной стенки (по методу В.И. Петрова, В.В. Новочадова, И.В. Смоленова, Н.В. Дегтевой, 2003 г.). Для осуществления данного метода перорально вводилась пациенту эквимолярная смесь (по 0,025 М/л) лактулозы и маннита из расчета 5 мл/кг массы. Затем в течение 3 часов осуществляли сбор мочи. Дальнейшее проведение методики осуществляли в биохимической лаборатории РСНПМЦ педиатрии. Для определения содержания восстанавливающих сахаров (до 90% из которых в условиях проводимой нагрузочной пробы составляет лактулоза) к 2 мл мочи прибавляли 1 мл 2н. раствора NaOH и 1 мл 0,3% водного раствора 2.3.5-трифенилтетразолия. Оставляли на 5 минут при комнатной температуре. Появляющуюся розовую окраску закрепляли прибавлением 1 мл 2М раствора уксусной кислоты (проба Л). Для определения содержания полиспиртов (подавляющую часть которых в условиях проводимой нагрузочной пробы составляет маннит) параллельно в другой пробирке (проба М) к 2 мл мочи прибавляли 0,1 мл 0,03М раствора метапериодата натрия, оставляли на 5 минут, а затем проводили реакцию, как с пробой Л. Обе пробы спектрофотометрировали против разбавленной физиологическим раствором (1 : 1) мочи при длине волны 485 нм на спектрофотометре UltrospecII (LKB BIOCHROM).
Расчет соотношения осуществлялся по формуле:
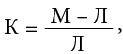
где К — показатель проницаемости, М — оптическая плотность маннита, Л — оптическая плотность лактулозы.
Проведение исследования было запланировано в рамках выполнения прикладного научного проекта при Министерстве здравоохранения Республики Узбекистан «Разработка дифференцированных методов лечения синдрома мальабсорбции у детей на основе оценки состояния проницаемости кишечного барьера». Шифр: ПЗ-20170925127. Информированное добровольное согласие родители/законные представители не подписывали. Исследование являлось добровольным и анонимным, о чем участникам исследования сообщали предварительно.
Статистическая обработка
Размер выборки предварительно не рассчитывали. Полученные данные подвергали статистической обработке на персональном компьютере Pentium 5 по программам, разработанным в пакете Excel с использованием библиотеки статистических функций с вычислением среднеарифметической (М), среднего квадратичного отклонения (σ), стандартной ошибки (m), относительных величин (частота, %), критерий Стьюдента (t) с вычислением вероятности ошибки (р). Различия средних величин считали достоверными при уровне значимости p < 0,05. При этом придерживались существующих указаний по статистической обработке данных клинических и лабораторных исследований. Корреляция проводилась по методу Пирсона.
Результаты
Участники исследования
Было обследовано 42 ребенка с целиакией, из них 28 — с впервые выявленным, 14 — с ранее установленным диагнозом, соблюдавших БГД, и 20 практически здоровых детей аналогичного возраста, которые составили контрольную группу. Средний возраст больных в первой группе составил 6,1 ± 1,2 года, во второй группе — 6,2 ± 1,5 года, в контрольной группе — 6,1 ± 3,8 года. Среди пациентов с целиакией преобладали девочки. Соотношение мальчики/девочки в группе пациентов с впервые выявленной целиакией было 8/20, среди детей на БГД — 4/10, в контрольной группе — 5/15.
Селективный дефицит IgA установлен у 3 детей, которым в дальнейшем проводили генетическое исследование HLA II класса.
Среди детей, диагноз которым был установлен впервые, классические признаки заболевания присутствовали у 21 (75,0%), атипичное течение определяли у 7 (25,0%) детей. Клиническая картина у пациентов с классическими симптомами заболевания проявлялась диареей, выраженным метеоризмом и нутритивной недостаточностью, пациенты с отставанием в росте и рефрактерной анемией без явных диспепсических проявлений со стороны желудочно-кишечного тракта были отнесены в группу детей с атипичным течением целиакии. Следует отметить, практически все дети были с поздно установленным диагнозом. Так, если при классической форме заболевания возраст манифестации заболевания составил 30,7 ± 5,5 мес., то возраст установления диагноза был 71,1 ± 11,2 мес. Хуже ситуация была у детей с атипичной формой заболевания. Возраст первых проявлений заболевания (анемия, отставание в росте) составил 37,9 ± 12,7 мес., диагноз «целиакия» был установлен в 95,0 ± 20,0 мес.
Снижение массо-ростового индекса было характерно для детей с классической формой заболевания, из которых у 6 детей имела место среднетяжелая и в 2 случаях — тяжелая белково-энергетическая недостаточность, при атипичной форме заболевания 4 пациента имели нормальные показатели индекса массы к росту, остальные трое детей — среднетяжелую форму белково-энергетической недостаточности.
Следует отметить, что в обеих группах отмечены высокие показатели антител к тканевой трансглутаминазе, многократно превышающие показатели здоровых детей, за исключением 3 пациентов с селективным дефицитом IgA (при классической форме уровень тканевой трансглутаминазы IgA был 187,2 ± 17,9 Е/мл, при атипичной — 183,4 ± 31,2 Е/мл). Морфологическая картина характеризовалась преимущественно деструктивными (46,4%), атрофическими (25,0%) и гиперпластическими изменениями (21,4%).
Исследования ФК продемонстрировали повышение его значений у детей с впервые установленным диагнозом примерно в 1,5 раза по сравнению с контрольной группой, причем не отмечено разницы между группами пациентов с типичной и атипичной целиакией (табл.).
Таблица.
Показатели фекального кальпротектина у детей с впервые выявленной целиакией
Table.
Fecal calprotectin values in newly diagnosed celiac patients
Количество, n | Пол (мальчики/девочки) | Средний возраст, лет | Среднее значение ФК, мкг/г | р | |
Первичные пациенты | 28 | 8/20 | 6,09 ± 1,2 | 36,6 ± 10,2 | <0,05 |
Классическая форма | 21 | 4/17 | 6,48 ± 1,5 | 35,4 ± 13,09 | <0,05 |
Атипичная форма | 7 | 4/3 | 8,2 ± 2,1 | 37,8 ± 12,6 | <0,05 |
Контрольная группа | 20 | 5/15 | 6,1 ± 3,8 | 20,9 ± 8,7 | 0,05 |
Как видно из таблицы, отмечается тенденция к повышению показателей ФК в обеих группах пациентов по сравнению с контрольной группой, однако статистически незначимая.
Пациенты с ранее диагностированной целиакией, находившиеся на БГД не менее года, были распределены на две группы, из них 6 детей имели эффект от БГД и 8 пациентов наблюдались с рефрактерным течением заболевания (приверженность диете подтверждалась отрицательным результатом повторного анализа на тканевую трансглутаминазу IgA), характеризующиеся постоянством симптомов и признаков мальабсорбции, связанных с атрофией ворсинок, у пациентов, которые придерживаются строгой безглютеновой диеты в течение более 12 месяцев [19–21].
Исследование показало, что в группе детей с рефрактерным течением заболевания показатели ФК были значительно выше, чем в группе до лечения и в контрольной группе: 77,9 ± 24 мкг/г, тогда как в группе детей с длительной ремиссией заболевания этот показатель соответствовал значениям детей с впервые установленным диагнозом (39,8 ± 10,2 мкг/г, p < 0,05).
В зависимости от состояния проницаемости тонкой кишки пациенты были разделены на три группы: первично установленная целиакия (28 детей), дети, находящиеся на строгой БГД с регрессией клинических признаков (6 детей), и с рефрактерным течением заболевания (8 детей) (рис.).
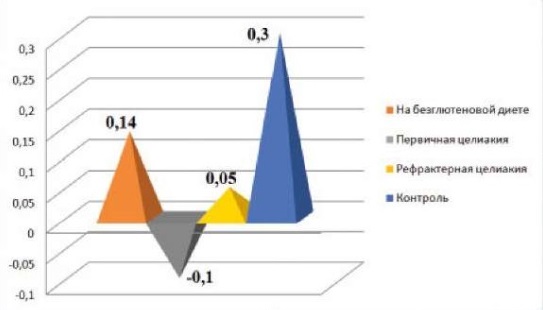
Рисунок.
Показатели проницаемости кишечной стенки у детей с целиакией (опт. ед.)
Figure.
Intestinal permeability values in CeD patients (optical units)
Результаты проведения теста с маннитом и лактулозой показали, что во всех трех группах отмечалось повышение проницаемости кишечной стенки по сравнению с контрольной группой из здоровых детей (0,3 ± 0,02 опт. ед., p < 0,05), наиболее заметное при впервые установленной целиакии (-0,1 ± 0,05 опт. ед.). Соотношение маннита и лактулозы в также было значительно снижено при рефрактерной целиакии 0,05 ± 0,004 опт. ед., что подтверждает нарушение целостности кишечного барьера. У детей на фоне БГД значение Л/М сдвинулось ближе к норме 0,14 ± 0,001 опт. ед., но все же не достигло значений контрольной группы.
Корреляционный анализ продемонстрировал прямую взаимосвязь между значениями ФК и проницаемостью тонкой кишки при рефрактерной целиакии (0,96, p < 0,05), в этой же группе детей выявлена положительная корреляция между дефицитом роста (0,48, p < 0,05) и отрицательная связь с показателями гемоглобина (-0,39, p < 0,05).
Обсуждение
Выявлено повышение уровня ФК у пациентов с впервые установленным диагнозом по сравнению с контрольной группой. В группе детей с рефрактерным течением заболевания показатели ФК были значительно выше, чем в группе до лечения и в контрольной группе. Результаты оценки состояния кишечного барьера показали, что у пациентов с целиакией отмечалось повышение проницаемости кишечной стенки по сравнению с контрольной группой из здоровых детей, наиболее заметное — при впервые установленной целиакии. Корреляционный анализ продемонстрировал прямую взаимосвязь между значениями ФК и проницаемостью тонкой кишки при рефрактерной целиакии.
ФК выделяется активированными нейтрофилами при воспалительных заболеваниях желудочно-кишечного тракта (язвенный колит, болезнь Крона). Было продемонстрировано, что его концентрация тесно связана с выраженностью воспаления в слизистой кишечника при данных заболеваниях [24]. В наших исследованиях установлено, что концентрация ФК у детей с впервые установленным диагнозом была сравнительно выше по сравнению с контрольной группой, но превышение было незначительное и показатели находились в пределах референсных значений. Также не было обнаружено различий в показателях ФК при различных фенотипах заболевания.
Carroccio и соавт. описывают повышение концентрации ФК у пациентов с целиакией (более 50 мкг/г) у 5 из 10 взрослых и 6 из 13 детей [25]. В другом исследовании было установлено, что дети с целиакией имели значительно более высокие значения ФК по сравнению с контролем, которые приближались к нормальным значениям через 4 недели БГД [26]. В отличие от результатов вышеупомянутых исследований, Montalto и соавт. [27] не обнаружили статистически значимую разницу между взрослыми пациентами с целиакией и контрольной группой и не установили корреляции между концентрацией ФК и гистологической тяжестью поражения. Тогда как C.R. Berni и соавт. предложили использовать ФК в качестве маркера соблюдения диеты в сочетании с другими тестами [26].
Данные, подтверждающие роль ФК в диагностике и наблюдении пациентов с целиакией, были представлены турецкой исследовательской группой под руководством Necati Balamtekin и соавт. [20]. В их работе среднее значение ФК у пациентов с недавно диагностированной целиакией составило 117,2 мкг/г, что значительно превышало показатели здоровых детей (9,6 мкг/г). Причем пациенты с типичными желудочно-кишечными симптомами заболевания имели более высокий уровень ФК по сравнению с пациентами с внекишечными симптомами, что не совпадает с полученными в настоящем исследовании данными. В динамике наблюдения после назначения БГД исследователи отметили статистически значимое снижение уровня ФК до среднего значения 4,2 мкг/г, что совпадало по времени с нормализацией IgA-антител к эндомизию. Схожие результаты были получены в исследовании Ertekin и соавт. [22]: исходные уровни ФК у детей с впервые диагностированной целиакией составляли 13,4 мкг/г, а через год терапии БГД они снизились до 4,6 мкг/г, что сопоставимо с контрольной группой здоровых детей (4,3 мкг/г).
Однако данные польской группы оказались противоположными: исследователям не удалось установить достоверную связь между концентрацией ФК, клинической формой целиакии (классическая, неклассическая, бессимптомная) и выраженностью гистологических изменений в тонкой кишке [21]. Вследствие отсутствия статистически значимой корреляции авторы сделали вывод о низкой диагностической ценности ФК в данном контексте. Этот вывод был дополнительно подтвержден результатами итальянского исследования у взрослых пациентов [19].
Умеренно повышенный ФК у больных с целиакией объясняют ложным повышением из-за незначительного воспаления слизистой оболочки прямой кишки вследствие нарушения всасывания питательных веществ или прохождения остаточных антигенных фрагментов глиадина через ободочную кишку и воспаления прямой кишки [27–28]. O. Biskou и соавт. [29] у взрослых пациентов с целиакией не выявили никаких существенных различий в средней концентрации ФК между леченой и нелеченой целиакией. У детей с рефрактерной целиакией медиана ФК была значительно выше, чем в контрольной группе и у детей с классическим течением болезни. Вместе с тем ни у одного из этих детей не было высоких показателей ФК (100 мкг/г), что было получено и в нашем исследовании.
Тем не менее, учитывая неоднозначность полученных данных ФК, нельзя окончательно исключить ФК как потенциальный маркер активности воспаления при целиакии. Выявленные уровни ФК можно интерпретировать как субклинический маркер низкоинтенсивного воспаления и нарушения кишечного барьера, характерного для рефрактерных и хронических форм целиакии. Необходимы дальнейшие проспективные исследования, которые позволят более точно определить роль ФК в диагностике и мониторинге заболевания.
Интересно, что даже в тех исследованиях, где отмечалось достоверное повышение уровня ФК у пациентов с активной целиакией, средние значения зачастую не превышали общепринятый диагностический порог (< 50 мкг/г), что ограничивает использование данного маркера в рутинной клинической практике. В то же время более поздние ретроспективные наблюдения показали, что уровень ФК > 50 мкг/г чаще регистрируется у пациентов с осложненной целиакией и нецелиакийными энтеропатиями, чем при неосложненной форме [19].
Полученные результаты подчеркивают необходимость проведения дальнейших проспективных исследований, в которых будет учитываться исходная выраженность нейтрофильной инфильтрации, а также иные факторы, потенциально влияющие на исходы. Такой подход позволит более точно определить диагностическую и прогностическую значимость ФК при целиакии.
Ограничения исследования
Возможное наличие информационных ошибок. Небольшое количество больных. Существует вероятность ненадежного воспроизведения матерями информации о приверженности диете и наличия ложноотрицательных результатов при повторном анализе антител к тканевой трансглутаминазе. Не проводилось иммуногистохимическое типирование для уточнения типа рефрактерной целиакии и исключения возможного поступления скрытого глютена.
Заключение
Выбор ФК как биомаркера при целиакии требует дополнительного методологического обоснования. В представленном исследовании ФК был выбран как универсальный маркер нейтрофильного воспаления, отражающий состояние слизистой кишечника по всей длине желудочно-кишечного тракта, включая как тонкий, так и толстый кишечник. В нашем исследовании мы стремились не только зафиксировать повышение ФК, но и установить взаимосвязь между его уровнем и нарушением кишечной проницаемости как возможным отражением системного воспалительного ответа. Таким образом, выбор кальпротектина опирался на гипотезу, что у детей с рефрактерной целиакией активация нейтрофильного звена и повреждение барьерной функции могут быть более выражены, чем при первичной форме заболевания. Этот подход согласуется с современными патофизиологическими представлениями о целиакии как заболевании, включающем и иммунное, и воспалительное звено повреждения кишечного барьера. Концентрация ФК была недостоверно повышена по сравнению с контролем у детей с впервые установленной целиакией и независимо от варианта течения заболевания. У детей с рефрактерным течением заболевания показатели ФК превышали значения здоровых детей в 3,8 раза, и в 1,8 раза были выше значений пациентов с первично диагностированной целиакией. Выявлена высокая корреляционная связь между повышенными значениями ФК и проницаемостью кишечника у детей с рефрактерным течением заболевания.
Вклад авторов / Author contribution
С.И. Геллер — проведение исследования, написание текста статьи.
А.Т. Камилова — идея, подготовка текста статьи, координация работы авторской группы утверждение окончательного варианта статьи.
З.Е. Умарназарова, К.Ш. Усманова — проведение исследования, редактирование статьи.
Svetlana I. Geller — conceptualization, investigation, writing (the original draft, reviewing and editing).
Altinoy T. Kamilova — conceptualization, writing (the original draft), coordination of the authors, approval of the final version.
Zulkhumar E. Umarnazarova, Kamola Sh. Usmanova — investigation, writing (reviewing and editing).
Список литературы
1. Аверкина Н.А., Баранов А.А., Бельмер С.В., Бораева Т.Т., Боровик Т.Э., Бушуева Т.В. и соавт. «Целиакия-2025»: проект клинических рекомендаций по диагностике и лечению целиакии у детей. Педиатрическая фармакология. 2025;22(4):495–522. doi: 10.15690/pf.v22i4.2941.
2. Камилова А.Т., Азимова Н.Д., Захарова И.Н. Глютен-ассоциированные заболевания: обзор литературы. Часть 1. Педиатрия (Consilium Medicum). 2023;3:173–178. doi: 10.26442/26586630.2023.3.202389.
3. Dube C., Rostom A., Sy R., Cranney A., Saloojee N., Garritty C., et al. Th e prevalence of celiac disease in average-risk and at-risk Western European populations: a systematic review. Gastroenterology. 2005;128:57–67. doi: 10.1053/j.gastro.2004.10.007.
4. Caio G., Volta U., Sapone A., Leffler D.A., De Giorgio R., Catassi C., et al. Celiac disease: a comprehensive current review. BMC Med. 2019;17:142. doi: 10.1186/s12916-019-1380-z.
5. Камилова А.Т., Умарназарова З.Э., Абдуллаева Д.А., и др. Частота и структура глютензависимых заболеваний у пациентов детского гастроэнтерологического профиля в Узбекистане: когортное проспективное исследование. Педиатрия им. Г.Н. Сперанского. 2024;103(4):100–109. doi: 10.24110/0031-403X-2024-103-4-100-109.
6. Wu J., Xia B., von Blomberg B.M.E., Zhao C., Yang X.W., Crusius J.B.A., et al. Coeliac disease: emerging in China?
7. Gut. 2010;59(3):418–419. doi: 10.1136/gut.2009.180323. Singh P., Arora S., Singh A., Strand T.A., Makharia G.K. Prevalence of celiac disease in Asia: a systematic review and meta-analysis. J Gastroenterol Hepatol. 2016;31(6):1095–1101. doi: 10.1111/jgh.13270.
8. Kamilova A.T., Azizova G.K., Poddighe D, et al. Celiac disease in Uzbek children: insights into disease prevalence and clinical characteristics in symptomatic pediatric patients. Diagnostics (Basel). 2023;13(19):3066. doi: 10.3390/diagnostics13193066.
9. Татьянина О.Ф., Потапов А.С., Намазова Л.С. и др. Фекальный кальпротектин — маркер кишечного воспаления при заболеваниях кишечника у детей. Педиатрическая фармакология. 2008;5(3):13–19.
10. Carroccio A., Jacono G., Cottone M. Diagnostic accuracy of fecal calprotectin assay in distinguishing organic causes of chronic diarrhea from irritable bowel syndrome: a prospective study in adults and children. Clin Chem. 2003;49:861–867. doi: 10.1373/49.6.861.
11. Kamilova A.T., Azizova G.K., Umarnazarova Z.E., Abdullaeva D.A., Geller S.I. Th e activity of antimicrobial peptides in pediatric celiac disease. Front Pediatr. 2022;10:873793. doi: 10.3389/fped.2022.873793.
12. Nakatani Y.Y., Mikami M. Calprotectin (S100A8/S100A9), an infl ammatory protein complex from neutrophils with a broad apoptosis-inducing activity. Biol Pharm Bull. 2003;26(6):753–760. doi: 10.1248/bpb.26.753.
13. Stříž I., Trebichavský I. Calprotectin — pleiotropic molecule in acute and chronic infl ammation. Physiol Res. 2004;53(3):245–253.
14. Weh J. Discriminatory potential of C-reactive protein, cytokines, and fecal markers in infectious gastroenteritis in adults. Diagn Microbiol Infect Dis. 2013;77(1):79– 84. doi: 10.1016/j.diagmicrobio.2013.06.018.
15. Хасанова С.С., Камилова А.Т. Прогностическое значение фекального кальпротектина у недоношенных с гестационным сроком при рождении менее 32 недель. Современная педиатрия. 2019;(1):26–29.
16. Damms A., Bischoff S.C. Validation and clinical significance of a new calprotectin rapid test for the diagnosis of gastrointestinal diseases. Int J Colorectal Dis. 2008;23:985–992. doi: 10.1007/s00384-008-0502-6.
17. Jacob M., Foster R., Sigthorsson G., et al. Role of bile in pathogenesis of indomethacin-induced enteropathy. Arch Toxicol. 2007;81:291–298. doi: 10.1007/s00204-006-0134-0.
18. Yagmur E., Schnyder B., Scholten D., et al. Elevated concentrations of fecal calprotectin in patients with liver cirrhosis. Dtsch Med Wochenschr. 2006;131:1930–1934. doi: 10.1055/s-2006-951723.
19. Capone P., Rispo A., Imperatore N., Caporaso N., Tortora R. Fecal calprotectin in celiac disease. World J Gastroenterol. 2014;20(2):611–612. doi: 10.3748/wjg.v20.i2.611.
20. Balamtekin N., Demir H., Baysoy G., Uslu B., Orhan D., Akçören G., et al. Fecal calprotectin concentration is increased in children with celiac disease: relation with histopathological fi ndings. Turk J Gastroenterol. 2012;23(5):503–508. doi: 10.4318/tjg.2012.0366.
21. Montalto M., Santoro L., Curigliano V., D’Onofrio F., Cammarota G., Panunzi S., et al. Faecal calprotectin concentrations in untreated celiac patients. Scand J Gastroenterol. 2007;42(8):957–961. doi: 10.1080/00365520601173632.
22. Ertekin V., Selimoglu M.A., Turgut A., Bakan N. Fecal calprotectin concentrations in children with celiac disease. J Clin Gastroenterol. 2010;44:544–546. doi: 10.1097/MCG.0b013e3181cadbc0.
23. Husby S., Koletzko S., Korponay-Szabó I., et al. European Society Paediatric Gastroenterology, Hepatology and Nutrition guidelines for diagnosing coeliac disease 2020. J Pediatr Gastroenterol Nutr. 2020;70(1):141–156. doi: 10.1097/MPG.0000000000002497.
24. Shitrit A.B., Braverman D., Stankiewics H., et al. Fecal calprotectin as a predictor of abnormal colonic histology. Dis Colon Rectum. 2007;50:2188–2193. doi: 10.1007/s10350-007-9058-y.
25. Carroccio A., Iacono G., Cottone M., et al. Diagnostic accuracy of fecal calprotectin assay in distinguishing organic causes of chronic diarrhea from irritable bowel syndrome: a prospective study in adults and children. Clin Chem. 2003;49:861–867. doi: 10.1373/49.6.861.
26. Berni C.R., Rapacciuolo L., Romano M.T., et al. Diagnostic value of faecal calprotectin in paediatric gastroenterology clinical practice. Dig Liver Dis. 2004;36:467–70. doi: 10.1016/j.dld.2004.01.014.
27. Ensari A., Marsh M.N., Loft D.E., et al. Morphometric analysis of intestinal mucosa. Quantitative histological and immunocytochemical studies of rectal mucosae in gluten sensitivity. Gut. 1993;34:1225–1229. doi: 10.1136/gut.34.9.1225.
28. Ensari A., Marsh M.N., Shethah M., Lobley M., Unsworth D.J., et al. Diagnosing coeliac disease by rectal gluten challenge: a prospective study based on immunopathology, computerized image analysis and logistic regression analysis. Clin Sci (Lond). 2001;101:199–207. doi: 10.1042/cs1010199.
29. Biskou O., Gardner-Medwin J., Mackinder M., Bertz M., et al. Calprotectin in treated and untreated children with coeliac disease and juvenile idiopathic arthritis. J Pediatr Gastroenterol Nutr. 2016;63:112–115. doi: 10.1097/MPG.0000000000001034.
Об авторах
С. И. ГеллерУзбекистан
Геллер Светлана Игоревна, к.м.н., докторант отдела гастроэнтерологии
Scopus Author ID: 57199720552
улица 2-й Чимбай, проезд Талант, д. 3, Алмазарский район, г. Ташкент, 100179
А. Т. Камилова
Узбекистан
Камилова Алтиной Турсуновна, профессор, д.м.н., руководитель отдела гастроэнтерологии
Scopus Author ID: 6603459264
ResearcherID: R-7616-2018
улица 2-й Чимбай, проезд Талант, д. 3, Алмазарский район, г. Ташкент, 100179
З. Е. Умарназарова
Узбекистан
Умарназарова Зульхумар Ерназаровна, д.м.н., главный научный сотрудник отдела гастроэнтерологии
улица 2-й Чимбай, проезд Талант, д. 3, Алмазарский район, г. Ташкент, 100179
К. Ш. Усманова
Узбекистан
Усманова Камола Шавкатовна, базовый докторант отдела гастроэнтерологии
улица 2-й Чимбай, проезд Талант, д. 3, Алмазарский район, г. Ташкент, 100179
Рецензия
Для цитирования:
Геллер С.И., Камилова А.Т., Умарназарова З.Е., Усманова К.Ш. Клиническая значимость определения фекального кальпротектина у детей с целиакией: одномоментное исследование. Архив педиатрии и детской хирургии. 2025;3(2):33-42. https://doi.org/10.31146/2949-4664-apps-3-2-33-42
For citation:
Geller S.I., Kamilova A.T., Umarnazarova Z.E., Usmanova K.Sh. Clinical implications of the determination of fecal calprotectin in children with celiac disease: A cross-sectional study. Archives of Pediatrics and Pediatric Surgery. 2025;3(2):33-42. (In Russ.) https://doi.org/10.31146/2949-4664-apps-3-2-33-42
JATS XML